《医疗器械生产质量管理规范(2014版)》(以下简称《规范》)标志着医疗器械生产行业最严监管时代的来临。
国家食药监管总局要求,从2016年1月1日起所有第三类医疗器械生产企业必须符合《规范》要求,其他医疗器械生产企业应于2018年1月1日符合《规范》要求。
今年春年前后,国家局下发通知,要求各地食药监管部门针对第三类医疗器械生产企业开展督查。广东、安徽、浙江三省已开先河,不少械企被限期整改、停产整改,乃至注销。相关情况,中国医疗器械近期都有报道。
问题来了,史上最严监管究竟是如何具体实施的?
据悉,安徽省食药监局近日出台的《关于监督实施医疗器械生产质量管理规范的意见》规定,在日常监督检查中,只要发现企业一般项目不符合要求的,一律责令企业限期整改;若是关键项目不符合要求,或者虽仅有一般项目不符合要求但会对产品质量产生直接影响的,企业必须停产整改;情节严重的,或将直接被吊销生产许可证。
从中不难看出,关键项目不合要求就停产整改,可谓一拳定生死。而停产对企业的灾难性影响则是不言而喻。
那么,会导致企业停产的“关键项目”都有啥?
去年10月,国家局在其官网上发布了4份现场检查指导原则,包括一个总的原则,以及三种具体类型的原则(无菌、植入性医疗器械和体外诊断试剂)。
中国医疗器械将其中的关键项目汇总如下,共计57项:
1、机构和人员,计5项

备注:未经特殊说明的均为共有关键项目,各类型企业均需遵守的,以下同。
2、厂房与设施,计8项
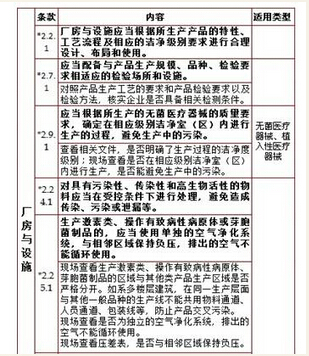

3、设备,计3项

4、文件管理,计2项

5、设计开发,计2项

6、采购,计12项
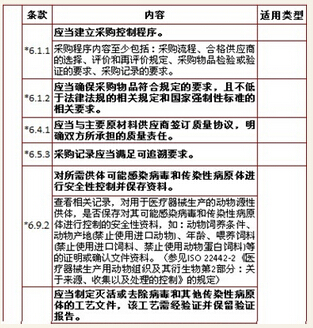
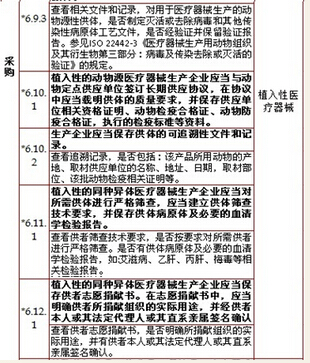
7、生产管理,计11项
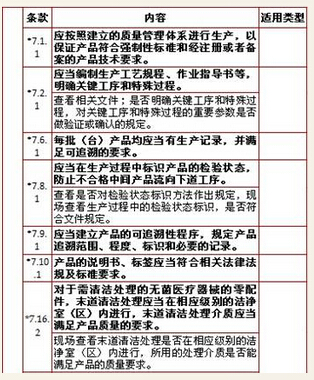
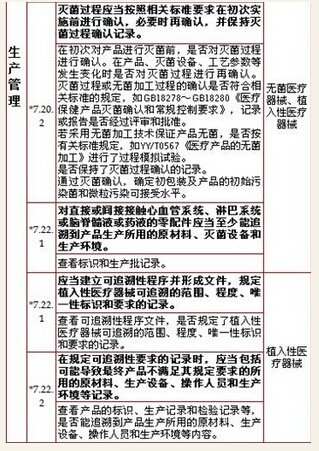
8、质量控制,计8项
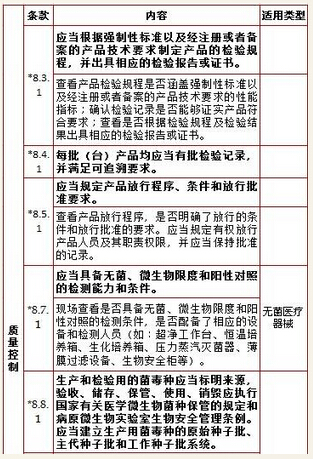
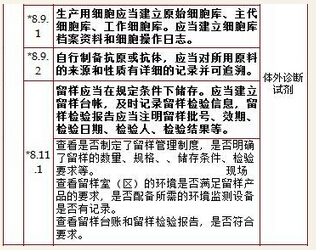
9、销售和售后服务,计1项
*9.1.1 应当建立产品销售记录,并满足可追溯要求。
10、不合格品控制,计1项

11、不良事件监测、分析和改进,计4项

经过梳理,中国医疗器械发现,此次督查不可不谓时间紧、任务重、动真格。
比如安徽省要求在今年6月底前就完成所有第三类医疗器械生产企业质量管理体系的全面检查。而浙江全省236家第三类医疗器械生产企业中,已有20家被限期整改,6家被停产整改,还有4家主动停产,1家注销等等,占比近15%。预测日后会有更多省份陆续展开相关督查工作,新一轮督查风暴即将来袭!
此外,国家局要求,第三类以外的其他医疗器械生产企业也应于2018年1月1日符合《规范》要求。相信在未来两年时间里,风波将席卷整个医械圈,而不符合规范者将被淘汰出局。