2016年12月23日,上海市食品药品监督管理局发布关于优化本市第二类医疗器械审评审批流程的通知,对辖区内第二类器械首次注册、延续注册、许可事项变更、登记事项变更等事项的审评审批流程进行优化,并将于2017年2月1日起施行。
定睛一看,上海局的优化举措还真是给力:资料合并受理,审评审批时限压缩,豁免注册质量体系核查…为了让大家更直观地了解,小编将优化措施与步骤整合到注册流程图中,供大家参考:
——首次注册——
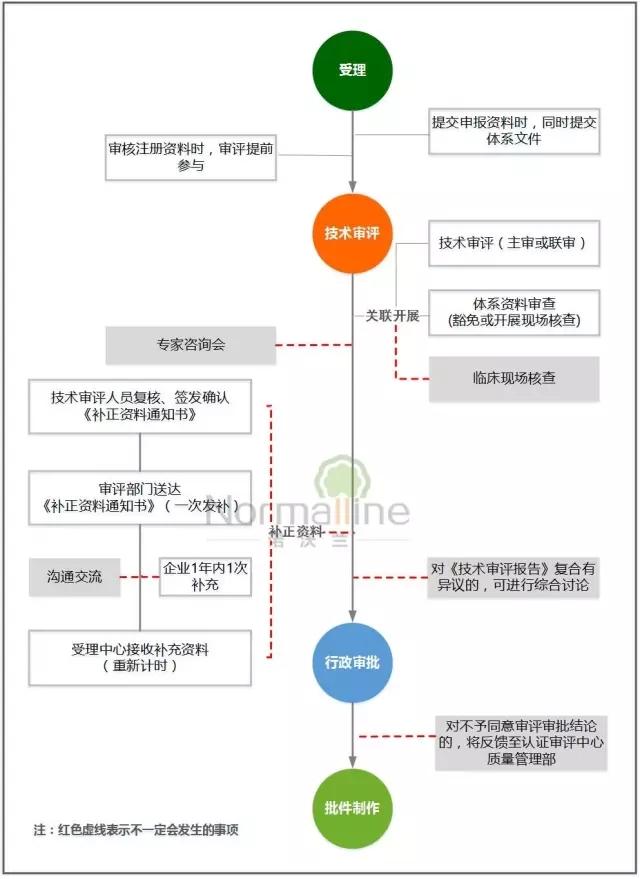
双同步:即在受理注册申请时可以同步接收相应的质量管理体系资料,减少企业往返、提高流转效率;技术审评与注册质量体系核查、临床试验现场核查同步开展,提高工作协同性;
双提前:即技术审评人员提前介入到受理环节,提高受理的资料质量,并保证注册收费工作顺利有序;技术审评的签发人员提前介入到复核环节,便于统一资料补正意见,有效控制审评时限,避免出现二次发补。
双试行:即根据产品风险及技术复杂程度,试行改变单一主审制,实行分级、分路和联合审查;按照本市医疗器械注册质量体系现场核查相关要求,试行优化、简化体系核查,减少重复核查。如申请注册的产品与该公司已获准注册产品具有相同工作原理、预期用途,并且具有基本相同的结构组成、生产条件、生产工艺,现场检查时,可仅对企业注册检验样品和临床试验用样品的真实性进行核查,重点查阅设计和开发过程实施策划和控制的相关记录、用于样品生产的采购记录、生产记录、检验记录和留样观察记录等。
双增设:即增设技术审评中的沟通交流、专家咨询、综合讨论等措施,提高审评的系统性和科学性;增设审批意见反馈机制,协调解决有争议的问题,进一步规范流程、统一审评审批尺度。
——延续注册——
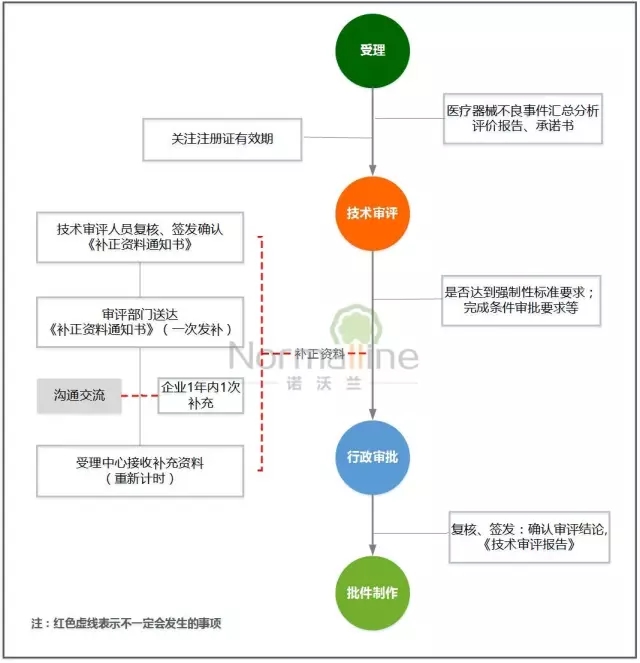
1、突出申请资料中对上市后产品不良事件汇总分析评价报告的要求;强化产品上市后质量跟踪。
2、突出不予延续注册三项法定要求的执行,严格把握延续注册的条件,即:注册人未在规定期限内提出延续注册申请的;医疗器械强制性标准已经修订,申请延续注册的医疗器械不能达到新要求的;对用于治疗罕见疾病以及应对突发公共卫生事件急需的医疗器械,未在规定期限内完成医疗器械注册证载明事项的;
3、突出延续注册各环节的简化:审评时限压缩5工作日,有发补的再审时限压缩15工作日;行政审批时限压缩5工作日。
——许可事项变更——
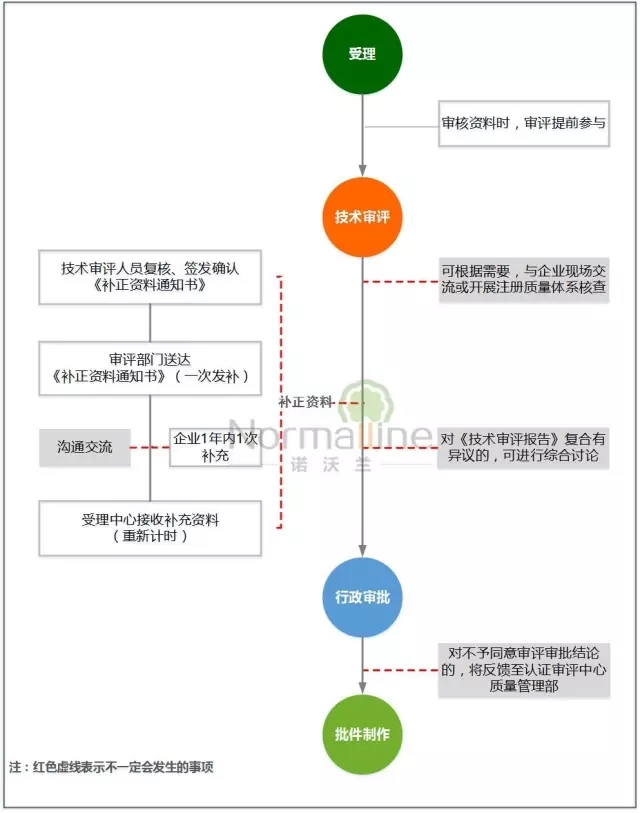
1、强化审评人员与申请人的现场交流,以便准确把握变更内容,减少重复的现场体系核查,提高审评效率;
2、考虑到许可事项变更的复杂性和多样性,借鉴首次注册的相关优化措施,保证审批质量。
——登记事项变更——
当场受理,免费办理,10个工作日内完成。具体的时间分配如下:




