eTMF,全称:electronic Trial Master File,一般译为“临床试验电子文档管理”。指的是用于管理药品临床试验的整个生命周期中文档的专业内容管理。
通常,为了遵守政府对药品临床试验的监管要求,每个参与临床试验监管的组织都必须储存临床试验相关的重要文件。所以为了保存信息,都是把信息储存在文件柜里的试验主文件夹或TMF里。
随着任务的加重,为了降低成本和加快临床试验审批流程,美国食品药品监督管理局(FDA)和欧洲药品局(EMA)等政府机构积极研究新举措,参与调节临床试验流程。在美国,FDA制定了支持在临床试验中使用电子记录和电子签名的联邦法规21章第11条款(21 CFR Part 11,主要规定内容涉及电子记录和电子签名)。在欧洲,EMA也发行政策支持临床试验中电子签名的使用。
通过自动化的电子企业内容管理,在确保遵从法规的前提下还降低了商业风险。就这样从TMF转换到eTMF渐渐广泛应用起来。
但有一个痛点是,eTMF还需要遵守各种各样的监管条例,如果管理不善或表现不佳, eTMF就会造成重大风险。
eTMF的主要职责是,对试验中各种类型的文档分别管理,主要包括一般文档、存档文档和申报文档等,并且详细记录对文档的操作信息。
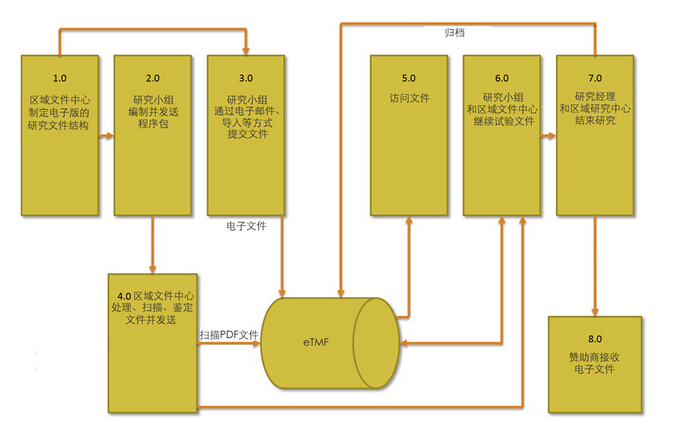
eTMF的流程
开发的eTMF大都具有如下功能:
1)文档创建、质量控制到审批;
2)合规的电子签名;
3)文档的版本与历史记录;
4)文档全文检索机制;
5)完整的报告汇总系统;
6)项目整体导出;
7)自动同步文件的修改、高级搜索;
8)针对大型、复杂的可交付成果的虚拟文档编辑;
9)自动信息交换;
10)广泛的文档目录;
11)可配置的原始数据;
12)文件清单和必要的文档跟踪;
13)预先配置的、可定制的工作流;
14)正式的文件夹结构和命名规范;
应用eTMF的好处
1)节省赞助商和研究员时间,提高临床试验效率;
2)提高临床试验文档的质量和完整性;
3)降低临床试验成本;
4)建立赞助商、合同研究组织CRO和其他第三方的无缝协作;
5)跟踪临床试验文件的进度,确保试用期间和之后快速、安全地访问文件;
6)简化和加快复杂临床试验文件的规划;
7)获得更高的临床试验的效率;
8)提高研究结果的准确性;
9)增加授权知识共享;
10)减少记录存储成本;
国内外eTMF发展现状
根据美国专注生命科学领域的软件公司Veeva 2014年的调查显示,合同研究组织(CRO)采用下一代记录研究文件的方式仍比较缓慢,仅13%在使用最先进的技术。而在我国药品临床试验的过程中,总体上也仍未脱离开纸张,几乎90%临床试验过程仍然采用手工记录、纸张提交及书面审查。尽管医疗机构改变缓慢,但国外提供临床试验电子文件管理服务的公司仍不在少数。
据动脉网整理,目前国外有Veeva、GoBalto、NextDocs、SureClinical、ConsultParagon、DB Integrations、EMC等。其中,有两家已进入中国市场,一家是全球软件应用服务巨头Veeva已于2011年正式涉足中国市场,并于2013年10月在纽约证券交易所挂牌上市;另一家是EMC,进驻中国近20年了,戏剧的是,其在中国“出名” 是因“秘书门事件”。
在国内,虽然与西方发达国家在新药研究中的电子化文件管理方面存在较大差距,但我们也发现了其中一家公司北京百奥知,其开发的BioKnow-eTMF就是针对临床试验文档管理。



