近日,来自美国威斯康星大学的华人科学家Su-Chun Zhang在国际学术期刊Cell Stem Cell发表了一项最新研究进展,他们利用CRISPR/CAS9技术实现了对人类干细胞系进行可诱导基因敲除,这一方法的成功对于研究基因在干细胞及分化不同阶段中的作用具有重要推动作用。
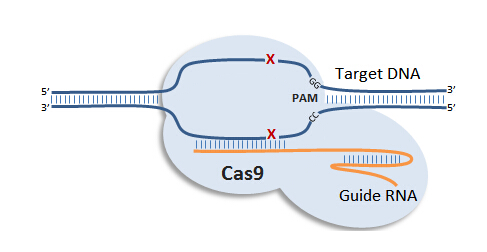
对基因表达进行精确的时间调控对于阐明一个基因在生物学系统中的功能至关重要,但到目前为止,在人类多能干细胞中实现可诱导基因敲除,建立可诱导基因敲除的人类干细胞系仍存在很大挑战。
在该项研究中,研究人员结合CRISPR/CAS9介导的基因组编辑和Flp/FRT以及Cre/LoxP系统成功实现建立了可诱导基因敲除的人类多能干细胞系。研究人员发现dual-sgRNA的靶向作用对于将FRT序列进行精确的双等位基因敲入非常重要。除此之外,他们还开发了出一种新的策略将一个可调控活性的重组酶表达体系同时导入细胞,移除了药物抗性基因,利用这种方法可以加快iKO hPSC细胞系的获得速度。
研究人员通过这种两步法敲除策略,对人类胚胎干细胞和诱导多能干细胞中的SOX2,PAX6,OTX2,AGO2等基因实现了可诱导性基因敲除,建立了相关细胞系。
研究人员相信,利用这种方法建立iKO hPSC细胞系将会改变人们以往对人类细胞中基因功能研究的方式,对于推动干细胞研究进展具有重要意义。



