干细胞技术作为一种革命性的技术,给无数患者带来了新的希望,同时也开创了一个朝阳产业。但是各种干细胞治疗技术的有效性、安全性仍有待验证;一些开展干细胞治疗的企业、医院为追求高额利润,开展非法干细胞治疗,严重侵犯了患者的合法权益。各国干细胞产业出现监管乱象,需要国家法律有效规制。
最近(8月28日),FDA(美国食品药品监督管理局)发出了一封警告信,控诉佛罗里达州的US Stem Cell Clinic of Sunrise以及首席科学官Kristin Comella使用未经FDA审批通过的干细胞产品从事商业运营并且生产车间严重不符合生产质量管理规范,可能导致产品不育性的严重后果,给患者带来巨大的生命风险。
具体内容显示,2017年4月10日到5月11日FDA 在该中心展开了为期一个月的例行检查,发现该中心用脂肪干细胞提取液直接静脉滴注给患者脊髓部位,声称治疗各种疑难杂症,包括帕金森氏病, 肌萎缩侧索硬化症 (ALS), 慢性阻塞性肺疾病 (COPD), 心脏病, 肺纤维化等。另外,在该中心官网上还看到干细胞治疗在类风湿关节炎, 克罗恩病, 结肠炎, 狼疮等疾病应用的宣传介绍。在FDA检查时,该中心还百般抵赖用各种理由干扰FDA例行检查。(警告信原文)

附警告信截图
FDA局长Scott Gottlieb博士表示:这些为患者实施干细胞治疗的诊所工作人员甚至于不是医生。这些诊所对外宣扬,干细胞治疗技术并不需要FDA的审批,因为治疗使用的干细胞取自患者本身。而这一尚未成熟的技术一旦在未经FDA临床审批投入给那些脆弱的患者面前,并让病人相信这一技术是安全有效并且合法的,将会剥夺了患者的知情权,置他们于危险而不顾。FDA作为监管者无疑应进一步采取措施,加强干细胞研究及转化应用产业制度的完善、加强相关诊所滥用患者信任非法治疗的执法行动,解决监管漏洞的问题,且敲响亟需重视和整顿的警钟。
干细胞技术“鱼龙混杂” 监管问题刻不容缓
早在2012年,FDA已发布一个公开警示并发送了一系列警告信给一些独立诊所,内容主要是对不孕不育和其他一些疾病的警戒。
2014年3月15日与3月16日在中央电视台“焦点访谈” 连续两天报道浙江无锡“非法干细胞治疗事件”:2011年,58岁的昆明市民张某被查出身患结肠癌晚期,一个偶然的机会,他们听说,无锡某干细胞公司拥有一种非常有效的治疗方法,说人体干细胞很有用,能治好。并且其董事长跟他们说:“一般的癌症根本没有问题。你这个病很有希望的,如果不来我们这里的就没救了。”一个剂量12万元,一个疗程36万元。张某的女儿凑足了36万元,汇到该公司的账户上。第二天该公司把张某夫妇带到了无锡市滨湖区的一家社区医院为张某进行胚胎干细胞治疗。2012年3月30日,公司人员告诉他们,治疗结束,效果很好,可以回家休养。而当一家人回到昆明,张某的病情远没有像该公司所承诺的那样,向好的方向发展,能再活十年,而是急转直下,短短三个月便不幸去世。
2016年6月30日,Cell子刊《Cell Stem Cell》在线发表了一篇最新研究,揭示了美国干细胞治疗市场的乱象问题:至少有351家企业参与直接面向患者的干细胞治疗项目,且提供这些治疗的医疗诊所多达570家。
2016年9月7日,Nature发表一篇关于未经证实细胞治疗的热潮加剧监管的争论的论文,文中描述了一个真实的案例:Thomas Albini,一名就职于迈阿密大学的眼科医生。从去年开始,他遇到过至少两位因为接受“干细胞治疗”而导致失明的患者。其中一位老年妇女因为黄斑变性疾病曾付钱接受了所谓的干细胞临床试验,诊所的医生宣称通过将干细胞注入双眼可以治疗眼疾。不幸的是,最终这种未经审批的试验不仅没有起到治疗效果,反而使其双目失明。
2017年8月28日,FDA局长Scott Gottlieb在声明中指出,加州圣地亚哥的干细胞免疫治疗中心(公司)使用未经批准的干细胞(从脂肪组织中提取)制剂混合牛痘疫苗直接静脉滴注给肿瘤患者。曝光的干细胞免疫和干细胞治疗中心是:加州圣地亚哥的 Stem Immune Inc和加州Rancho Mirage和Beverly Hills 的California Stem Cell Treatment Centers。
以上案例,均揭示了干细胞治市场国内外监管欠缺,打防结合、标本兼洁、整顿与规范并重的监管亟需解决,从而确保人民的身体健康和生命安全。
干细胞“正品”屈指可数
干细胞是一类具有不同分化潜能,并在非分化状态下自我更新的细胞。用于治疗的干细胞主要包括成体干细胞、胚胎干细胞以及诱导的多能性干细胞。技术人员可以应用人自体或异体来源的干细胞经体外分离、纯化、培养、扩增、修饰、诱导分化、冻存及冻存后的复苏等过程后回输(或植入)人体,用于疾病预防和治疗。
随着全球老龄化趋势的不断加重,退行性疾病的发病率日趋上升,催生了以干细胞技术为核心的再生医学。细胞药物被认为是继化学药物、抗体药物之后的第三代药物。
据生物制药小编统计,截至目前,全球共批准8个干细胞药物,包括加拿大和新西兰获批的Prochymal和日本上市的Temcell等。
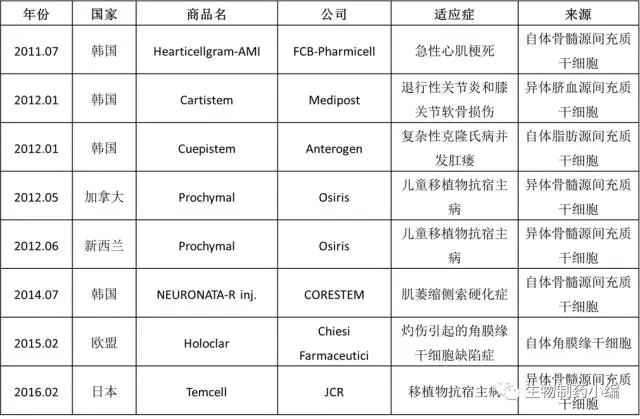
全球已上市的干细胞药物
我国虽然尚未批准胚胎干细胞技术的临床试验,但根据《2014-2019年中国干细胞医疗行业市场分析与投资前景预测报告》,中国目前干细胞的产业化应用主要在干细胞存储、细胞制备、研究技术、治疗解决方案以及相关基础服务等方面。目前已经上市的中源协和,还有后获得风险投资的北科生物都在这一领域开拓空间。我国目前批准设立的脐带血血库有10家, 截至目前验收合格正式营业的仅有山东、天津、北京、上海、广州、浙江、四川七家脐血库。脐带血含有大量的造血干细胞,这些造血干细胞可以诱导分化为各种血液细胞,如红细胞、白细胞、血小板等等。
干细胞技术研究如火如荼,克服四大门槛是关键
在美国、中国以及全世界各国,干细胞似乎成了万能细胞,受到医疗界高度重视。比方说修复受损的神经系统,恢复神经系统的功能,治愈因神经细胞受损导致的瘫痪。干细胞也可分化成新的胰腺细胞分泌胰岛素治疗糖尿病。从理论上讲,干细胞有望治愈用传统方法无法治愈的疾病,如糖尿病、老年痴呆症、心脏衰竭、红斑狼疮、黄斑变性、类风湿、恶性肿瘤等疾病。
此次,FDA展开对US Stem Cell Clinic of Sunrise公司的临床活动的监察,其该公司主要是以一种抽取患者或供体脂肪抽脂,再将提取脂肪干细胞并经过体外生物酶处理和富集过程,将这些干细胞混合液注射给患者脊髓中的干细胞治疗。但是该公司未能建立和遵循适当的书面程序, 以防止那些看来是无菌的干细胞产品的微生物污染, 从而使患者面临感染的风险。
干细胞制剂无论是作为药品还是医疗技术在应用于人体临床治疗之前,都必须证明它的安全性、有效性。而这个验证过程漫长而复杂,首先是动物实验、其次是第三方检测、然后再是临床试验。只有证明安全性与有效性后才能应用于临床治疗。
很多学者总结出干细胞治疗的隐患或者存疑的地方主要有以下四方面:
1.免疫排异反应
我们身体的免疫系统天天在击退微生物、病毒、有毒物质的入侵。我们的免疫系统发现这些异物(包括移植手术),便会发动一系列有害的攻击行为。这就是我们常说的免疫排斥反应。如果干细胞来自于异体,那就有可能引起免疫排斥反应。当然科学家可以通过对干细胞加工的方法,使它能够应对免疫系统,但这需要临床验证。
2.非定向分化
当医生期望注入的干细胞能够分化成为健康的神经细胞,修复神经系统,但是它却分化成了骨头与皮肤。如何准确地诱导干细胞分化成为制定的细胞,这还需要进一步研究。
3.细胞生长失控与致瘤性
正常的细胞生长是受控的,能够精确自我复制、恰当时候停止再生、专门分工、各司其职、受损自我凋亡。但是异体注入的干细胞制剂却不一定遵循这套严格的程序,不一定定向分化、不一定停止再生。当注入的细胞生长失控,就有可能生成肿瘤,比如iPS细胞致瘤性高达20%。
4.作用机理不太清楚
注入的干细胞制剂如何分化、如何分工、如何修复系统功能,以及异体干细胞存活多久,如何在体内发挥作用。对于这些问题还不是完全清楚。
从这些问题可以看出,干细胞治疗目前存在安全性问题。为此,去年FDA特地召集众多研究人员、企业主管以及患者代表汇聚至马里兰州的贝塞斯达,就细胞疗法的监管问题举办了为期两天的听证会,旨在更好地定义哪些细胞疗法应该接受严格的监管,起草指南监管起大量提供细胞治疗的诊所。在FDA的监管下,这些诊所必须确保细胞治疗的安全性,包括干细胞的采集、培养及储备。
我国对干细胞技术非常重视,政策扶持与监管并重。2006年初,国务院在《国家中长期科学和技术发展规划纲要(2006-2020)》中明确指出要大力发展生物技术,将“基于干细胞的人体组织工程技术”列入生物技术的前沿领域。
CFDA和卫计委2013年3月7日联合颁布《干细胞临床试验研究管理办法(试行)》、《干细胞临床试验基地管理办法(试行)》、《干细胞制剂质量控制及临床前研究指导原则(试行)》的征求意见稿,对干细胞制剂的制备及质量控制、临床前研究、临床试验及相关基地等做出详细规定,为干细胞药物上市审批指明了道路。
不久,为整顿干细胞治疗行业的乱象,相信FDA已经做好准备对此设置更高的行业标准,并通过FDA MedWatch Online Voluntary Reporting平台让行业专家及消费者人群共同参与进来,期望干细胞技术早日真正服务于广大患者。



