最近,一项发表在国际杂志Cell Reports上的研究报告中,来自美国辛辛那提儿童医院医学中心和日本横滨市立大学的科学家们通过研究在实验室中利用组织工程化的人类胰岛开发出了一种新型的循环系统,该系统或能分泌出类似于胰岛素的激素,同时还能在移植小鼠中治疗突发性的1型糖尿病。
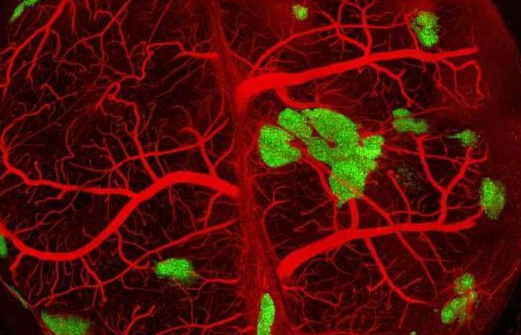
这项研究中,研究人员开发了一种名为自凝固的细胞培养系统(self-condensation cell culture),其能帮助研究人员利用人类机体自身的细胞生长出人类器官/组织从而用作再生医学的用途,医学博士Takanori Takebe说道,这种方法或能作为一种治疗1型糖尿病的重要策略,在其应用于临床治疗之前或许还需要进行额外的研究证实其有效性。
脱离自然的方式
研究者利用人类器官细胞、小鼠的器官细胞以及诱导多能干细胞检测了这种新型的系统,对一个成年人的机体细胞进行重编程或能使得诱导多能干细胞的行为类似于胚胎细胞,并且形成机体中任何的组织类型。这种组织工程学技术能利用两类胚胎期的祖细胞,这种细胞能够支持机体组织及特殊器官的形成,这些祖细胞称之为间质干细胞(MSNs)和人类脐带血管内皮细胞(HUVECs)。
利用捐献的器官细胞、小鼠细胞或诱导多能干细胞,研究人员就能将这些细胞与MSNs、HUVECs和其它能形成胰岛组织的遗传生化材料相结合,在能够滋养细胞的状况下,这些成分就会浓缩并自行组织形成胰岛组织。当组织工程化的胰岛组织被移植到患严重1型糖尿病的人源化小鼠机体中时,其就会治疗动物的疾病。
血液来源的挑战
如今人类的胰岛组织能被移植到糖尿病患者体内用于治疗,但很不幸的是,移植成功的概率相对较低,因为在移植之前,当胰岛被处理时其就会失去血管和血液的供应,这或许就会使得患者很难获得最大的健康益处。尽管基于干细胞的组织工程学技术具有非常大的治疗潜力,但未来科学家们仍然面临着巨大的挑战。
研究者Taniguchi说道,我们需要开发一种新型策略,通过实时地发育血管网络来确保移植的成功率,本文中我们发现,这种自凝固的细胞培养系统会促进组织的血管生成,利用这种新型技术所产生的胰腺胰岛组织工程学策略不仅能在胰岛移植后快速产生血管网络,而且还能有效发挥作用。
最后研究者表示,如今我们能够利用这种自凝固的细胞培养系统来帮助我们进行研究,即利用诱导多能干细胞功能性地产生三维的人类肝脏类器官,当其移植到实验室小鼠体内后就能够快速形成血管,但如何能够在人类机体中产生能够具有血管化的器官组织片段,比如胰岛组织,研究人员或许还需要进行更为深入的研究。



