上周日傍晚,你的朋友圈可能被一条疫苗生产记录造假的消息刷爆。国家药监局发文点名长春长生生物科技有限责任公司的冻干人用狂犬病疫苗生产存在记录造假等严重违反《药品生产质量管理规范》行为,据国家药监局公告显示,此次狂犬病疫苗GMP违规行为正是国家药监局开展飞行检查发现。
而就在此事发出公告后的一周,国家药监局官网又已新增10家飞行检查通报企业,均因企业生产质量存在缺陷,被责成限期整改。
飞检用来惩戒违法违规
飞行检查对于食品、药品、医疗器械、化妆品企业生产和产品质量管理部门的工作者肯定不陌生,它是跟踪检查的一种形式,最早用于体育竞赛中对兴奋剂的检查。
原CFDA食品药品审核查验中心(简称核查中心)的工作人员表示,飞行检查是基于风险、投诉举报等开展的不预先告知的有因检查,具有突击性和更强的保密性、高效性等特点。目前已经成为破除地方保护、揭露并打击行业潜规则、严厉惩戒违法违规行为的强有力手段。
“开展飞行检查,对保密性要求尤其高,工作人员事先并不知道要查哪个企业,飞到企业所在城市后,才会拿到一个信封知晓被查对象。”这名核查中心的工作人员说,“在现场,企业会通过手机要求转移某些物证,我们就要求交出手机,通过手机上的聊天记录把证物找出来。”
此次长春长生事件发生后,吉林省食品药品监督管理局调查组进驻了该企业;并有新浪微博认证为微博2016十大影响力医疗大V的@疫苗与科学发微博指明:国家药监局已把所有电脑主机和相关人员手机都带走。

飞检力度还需加强
近年来,药监部门对药品质量的重视提升到了以往未曾有过的高度,质量标准不断趋严,监管力度持续加大,对药品质量监管的理念正逐渐从“重审批”向“重监管”转变,通过更新监管理念保障用药安全。
随着理念的变化,我国药品GMP生产质量检查也将从“五年行政认证模式”向“通过飞行检查进行事中事后动态监管的模式”转变。注册检查、飞行检查的频次与力度将逐渐增强,抽检的覆盖面将逐渐增大。
实际上近三年来,核查中心的检查工作量确实逐年攀升。核查中心工作人员表示,2017年开展现场检查的药品生产企业共计2415家次,是2015年的近3倍,2016年的2.5倍。
《2017年度药品检查报告》显示,2017年共开展药品GMP飞行检查涉及21个省(市)的57家次(图1),包括5家生物制品生产企业(含血液制品)、14家普通化学药品生产企业、28家中药制剂生产企业、7家中药饮片生产企业和3家中药提取物生产企业。中药制剂生产企业是我国飞检的首要关注对象,疫苗等生物制品生产企业飞检数量较少。
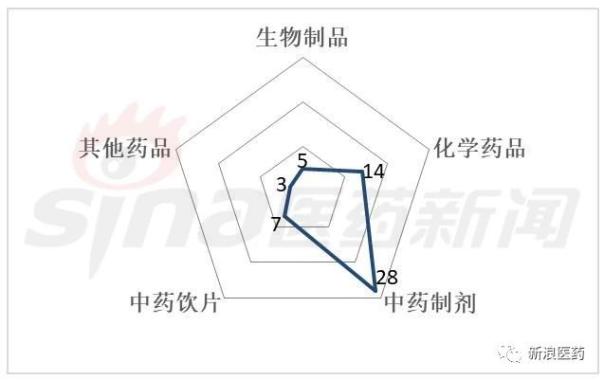
图1 药品飞行检查剂型分布情况
数量虽然提升了,但《中国医药行业供给侧改革专题研究》曾指出,对于真正落实动态质量监管,我国药监部门还面临着两个主要的挑战:一、存在较大的检查资源缺口;二、缺乏配套的奖惩机制,且多头监管难以真正落实惩罚措施和淘汰不合格企业。
据悉,新一批检查员上岗后,我国现有国家级药品检查员649名,但大多数为兼职,每年仅能执行约1500次现场质量检查,难以对全国近4700家药企形成全覆盖。省级以下市区层面受到专家资源库限制,药品生产质量检查多以流程简化的专项检查、日常检查为主,流于形式的隐患极大。另外,被他人举报或品质本身风险成为当前抽查企业的主要导火索,缺少对企业与场地综合风险的评估,生产质量风险较高的企业难以受到严格监管。[1]
对于违反生产质量规范的企业,依据我国《药品管理法》,要求企业限期整改,逾期未改企业将撤回GMP认证证书,勒令停产整顿并受到经济处罚,情节严重者可吊销《药品生产许可》与《药品经营许可》。然而现行的惩罚措施实施标准并不明确,依赖检查员主管判断多,灵活度大,企业很难真正重视生产质量规范。此外,目前药监部门颁布的飞检制度、GMP落实相关办法提及严重惩罚措施,但缺乏细则指引或法律约束,执行多遇阻碍。即使执行严格惩罚,各区域对下属管辖企业的惩罚程度也大相径庭。企业停产前大量生产转移库存销售,停产整改未完成继续开工等情况屡见不鲜。跨省检查受执法权限制,惩罚措施更是难以落实。[2]
等待更严格的监管措施出台
长春长生可以算是反应我国药品生产监督和惩罚力度不足的一个典型。在此次狂犬病疫苗违规事件发生半年多前,2017年11月,长春长生生产的百白破疫苗在药品抽样检验中被发现效价指标不符合标准规定。百白破疫苗效价指标不合格,虽对人体安全性没有影响,但可能影响免疫保护效果。事发后,原国家卫计委和三省市卫生计生部门组织专家进行评估后,采取了相应措施处理。
2018年7月18日,长春长生收到《吉林省食品药品监督管理局行政处罚决定书》(简称“处罚决定书”),该《处罚决定书》公布:
在国家药品专项抽验中,你公司生产的“吸附无细胞百白破联合疫苗”(批号:201605014-01),经中国食品药品检定研究院检验,检验结果【效价测定】项不符合规定。你公司生产的上述药品符合《中华人民共和国药品管理法》第四十九条第三款第六项“其他不符合药品标准规定的;”规定的情形,应按劣药论处。
你公司的行为违反了《中华人民共和国药品管理法》第四十九条第一款“禁止生产、销售劣药。”的规定,于2017年10月27日予以立案调查。
经查明,该批药品生产数量共253338支,由吉林省药品检验所抽样552支,销售到山东省疾病预防控制中心252600支,现库存186支,销售价格是3.40元/支,该批药品的违法所得共858840.00元,货值金额共861349.20元。
本局决定对你公司给予以下行政处罚:
1、没收库存的“吸附无细胞百白破联合疫苗”(批号:201605014-01)186支;
2、没收违法所得858840.00元。
3、处违法生产药品货值金额三倍罚款2584047.60元。罚没款总计3442887.60元(叁佰肆拾肆万贰仟捌佰捌拾柒元陆角整)。
据长春长生母公司长生生物2017年年报显示,该公司年营收15.5亿元,同比增长52.60%;实现归属于上市公司股东的净利润为5.6亿元,同比增长33.28%。其中,疫苗销售占营收收入99.10%。
面对如此营收体量的企业以及25万支没有免疫保护效果的疫苗被销往省级疾病预防中心,最终惩罚措施仅为罚末款344万元,惩罚力度明显不足。
7月15日,发生狂犬病疫苗违规行为后,长春长生的《药品GMP证书》(编号:JL20180024)已被国家药监局要求吉林省食品药品监督管理局收回。
同一厂家时隔半年多发现两次疫苗生产质量问题,不禁让人想到这背后存在的是企业意识和国家惩治力度的双缺失。《中国医药行业供给侧改革专题研究》提出,我国监管部门应明确违规违法行为责任主体,严肃问责并要求整改,并及时将检查结果公示,起到监督作用。整改期内,检查人员应通过指导与定期跟踪为企业提供专业支持。同时作为长期建设,可实行质量检查集中化管理模式,实现跨省监督与集中执法。与之相配套的是GMP体系建设,国家应建立基于风险评估的企业质量分级管理,标准化监管过程中的数据收集,确保监管质量后提升效率;并加速建立高水平的质量体系检查队伍。
但此次事件还是显示出了飞行检查在发现药品质量隐患时的作用,也提醒企业和监管部门维护公众用药安全性的重大责任。7月16日,长生生物发布公告道歉,并进行全面的自查和整改。我们期待事件的进一步处理结果,也期待整个行业更积极的变革。
参考资料:
[1] [2]:《中国医药行业供给侧改革专题研究》
来源:新浪医药新闻
作者:Kerr



