原标题:一文读懂肿瘤免疫治疗新贵--CAR-T(二)
免疫疗法是当下最受关注的肿瘤治疗的方法之一,随着PD-(L)1等免疫检查点抑制剂应用范围逐渐扩大,CAR-T疗法研究不断出现新的进展,CAR-T疗法作为有别于传统药物的“活药”,不仅对复发、难治性肿瘤患者表现出了突破性疗效,其生产体系和使用场景也有别于普通药物。
鉴于当下生物技术的更新速度,预计CAR-T疗法还将带给市场更多惊喜。本报告拟从CAR-T疗法技术基础入手,分析CAR-T疗法的局限性及研发方向、行业发展情况、研发情况与如何选择国内标的、投融资情况及行业总结。
一CAR-T的靶向抗原
CAR-T技术是靶向某一种抗原,而不是针对单一肿瘤疾病,因此靶点的选择是CAR-T有效性和安全性的基础。CAR-T靶向的肿瘤抗原可分为两类:
肿瘤特异性抗原:特异性地在肿瘤细胞表面表达,在正常组织中无表达,这是最理想的抗原。靶点抗原的特异性越高,CAR-T细胞就可越专一地针对特定的肿瘤细胞,对正常细胞不作用,从而降低机体不良反应。这种理想的抗原并不多,目前受到关注的有表皮生长因子受体EFGRvIII和前列腺特异性膜抗原PSMA等。
肿瘤相关抗原:在肿瘤细胞表面过度表达,在正常组织中低表达,目前大部分应用的肿瘤抗原靶点都是这种;肿瘤相关抗原可分为几种不同类型:免疫细胞的抗原通常与其抗原分化簇(CD)分型有关,包括CD19、CD20、CD22、CD30、CD33、CD269(BCMA)等;参与生长和分化信号的抗原,包括癌胚抗原(CEA)、表皮生长因子受体(EGFR、HER2)、酪氨酸激酶受体(EPHA2)等;参与肿瘤血管生成的抗原,包括血管内皮生长因子(VEGF)、VEGF受体(VEGFR)等;肿瘤支撑结构的肿瘤间质和细胞外基质抗原,包括纤维细胞激活蛋白(FAP)、tenascin蛋白等。
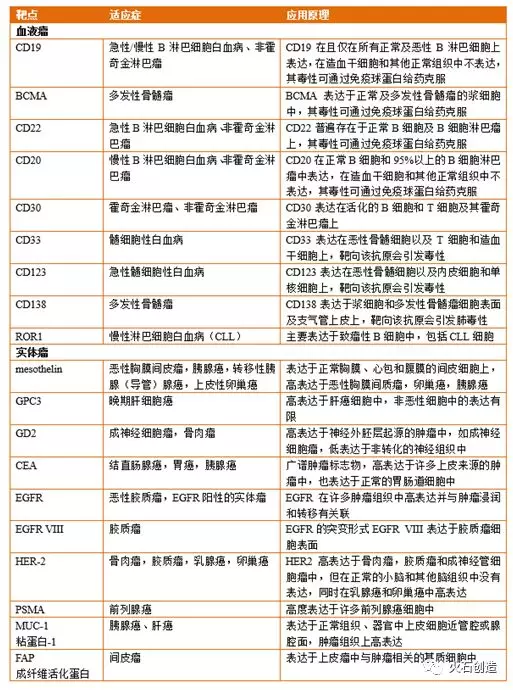
CAR-T的主要靶点及对应适应症和作用原理
资料来源:Nature Reviews/Clinical Oncology-,华创证券
从研发进展来看,应用于临床最成功的案例是以CD19为靶点构建的CAR-T(此前诺华和Kite Pharma获批的两个CAR-T 产品均以CD19为靶点),主要有两方面的原因,一方面,CD19抗原虽然是肿瘤相关抗原,但是它只在正常的B细胞和肿瘤B细胞上表达,以CD19为靶点的CAR-T会杀伤所有B细胞,当B细胞都被杀死之后,造血干细胞可以补充新的正常B细胞,患者也可以通过输入免疫球蛋白来补偿正常B细胞损伤所产生的影响,因此即使清除了患者体内的B细胞,通常也不会对患者的健康产生严重影响;另一方面,回输的CAR-T细胞自然归巢于血液器官,如血液、骨髓和淋巴结等,CAR-T与B细胞接触充分,有效作用杀伤。虽然以CD19为靶点的CAR-T细胞治疗效果很好,但是其适应症也局限在B细胞相关的血液肿瘤中,比如B系淋巴细胞白血病(急性、慢性)以及非霍奇金淋巴瘤(弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤、套细胞淋巴瘤等)。
白血病和淋巴瘤分类
资料来源:华创证券
除了靶点CD19,BCMA、CD20、CD22、CD30、CD33、CD123等靶点的开发均逐渐把CAR-T拓展到更广泛的血液肿瘤治疗上。这些靶点中,BCMA正在成为CAR-T治疗的热门靶点。BCMA作为一种极为重要的B细胞生物标志物,之所以引起极大关注,是因为它的RNA几乎总是在多发性骨髓瘤细胞中发现,并且该蛋白也存在于多发性骨髓瘤患者恶性浆细胞表面,而且,与CD19靶点类似,BCMA-CAR-T治疗后虽然也杀伤了正常的浆细胞,但患者可以通过免疫球蛋白给药来维持机体免疫力。虽然目前尚无相关产品获批上市,但在临床试验中,靶向BCMA的CAR-T疗法用于多发性骨髓瘤的治疗已经获得了很大的成功。美国bluebird bio和南京传奇生物的靶向BCMA治疗多发性骨髓瘤的CAR-T产品在临床试验中均达到了较高的客观缓解率(bluebird: 94%,南京传奇:100%)。
实体瘤靶点的研发较为困难,主要是因为以下三点:第一,几乎所有的靶点都是肿瘤相关抗原,CAR-T细胞在杀伤肿瘤细胞时容易误伤正常组织,发生“脱靶毒性”;第二,实体瘤是一群异质性肿瘤细胞,不同突变肿瘤细胞上的靶点不一样,单一种类的CAR-T很难杀光全部肿瘤细胞;第三,实体肿瘤就像独立的器官一样,拥有自己的血管、淋巴管、结缔组织等,周围的温度、pH、渗透压、细胞因子等微环境都与正常组织不一样,正常的免疫细胞以及CAR-T等都可能会被肿瘤微环境所抑制,不能发挥免疫反应。
2018年中国肿瘤登记年报数据显示,我国发病率最高的前10种癌症均为实体瘤,占全部癌症的比例高达77%。2017年美国癌症年报数据也显示,每年新增癌症病例中仅有不到5%的比例是血液肿瘤。因此,CAR-T实体瘤靶点的研发空间还非常巨大,任重道远。
据Cell Trials的统计,截至2017年10月,全球大约50%的 CAR-T临床试验针对CD19靶向抗原,另有一小部分(约6%)使用的是由CD19与另一抗原组成的组合抗原。除却CD19,CAR-T在血液肿瘤治疗方面还有许多其他抗原,其中BCMA、CD22、CD20较为常见。
CAR-T在血液肿瘤中最常见的靶向抗原(除了CD19)
资料来源:Cell Trials
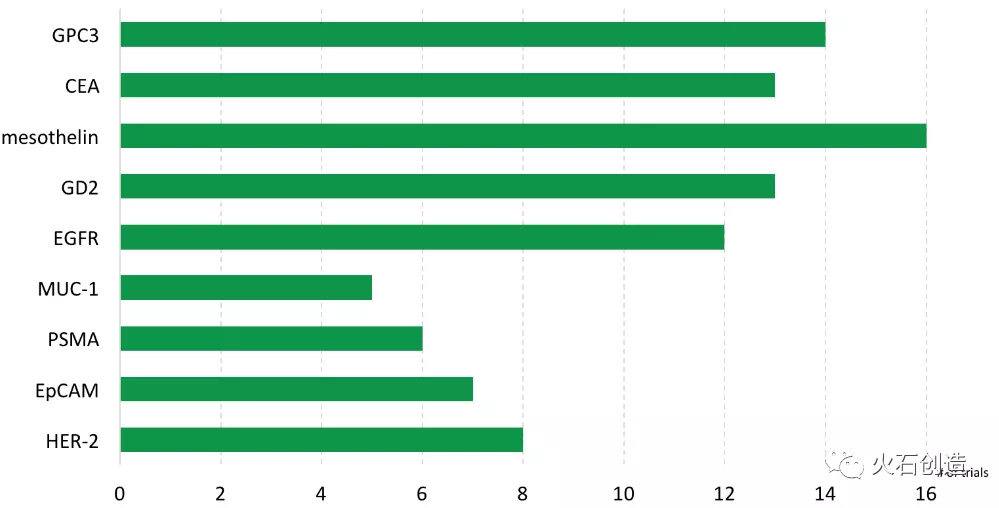
在实体瘤治疗方面,以间皮素(Mesothelin)为靶点的CAR-T临床试验数量暂时处于领先地位。作为一个潜在的良好靶点,间皮素在实体瘤细胞中大量表达,但在正常组织中的表达水平却很低。实验数据显示,间皮素在间皮瘤、胰腺癌和肺癌细胞表面均有表达。紧随其后,针对磷脂酰肌醇蛋白聚糖3(GPC3)靶点治疗肝癌、双唾液酸神经节苷脂2(GD2)靶点治疗神经母细胞瘤以及针对CEA靶点治疗肠癌的CAR-T疗法也受到了广泛关注。
CAR-T在实体瘤中最常见的靶向抗原
资料来源:Cell Trials
二CAR-T结构中抗体scFv的筛选
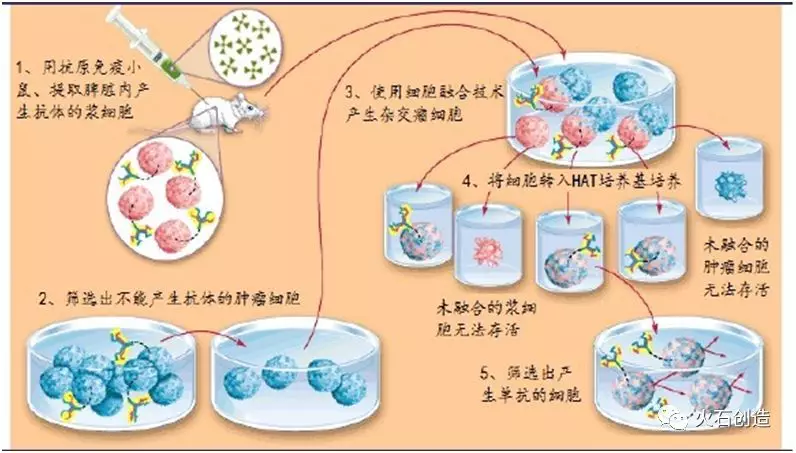
CAR是以抗体的scFv(单链可变区)识别肿瘤抗原的。因此,与单抗的研发路径类似,CAR-T的研发也需要获取和筛选单抗。杂交瘤技术是获取单抗的基础,该技术可获得相应的分泌单抗的杂交瘤细胞。筛选出亲和力高的单抗后,将相应的杂交瘤细胞冻存传代形成稳定的细胞株,用于CAR结构中scFv序列的构建。
杂交瘤技术流程图
资料来源:《浅谈抗体领域的研究成果》
scFv由重链、轻链以及之间的linker连接而成,所以将不同的重链和轻链随机组合,可以建成人源化的scFv组合抗体文库,再通过表达量、稳定性、与抗原的亲和力等指标进行筛选。如果收集携带特定肿瘤抗原的患者外周血B淋巴细胞(比如30-100例),通过提取其中的mRNA并反转录获得cDNA,也可以作为全人源抗体库的素材。
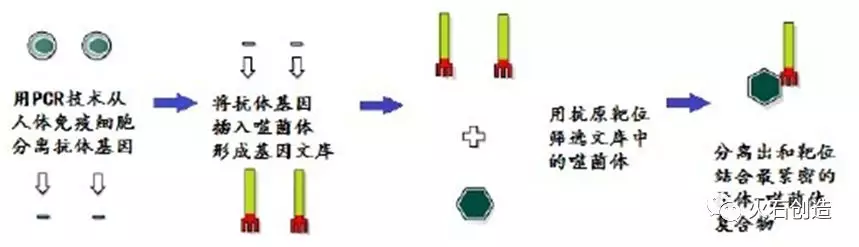
高通量筛选主要通过噬菌体展示技术。简单来说,噬菌体展示技术是将外源的抗体基因与噬菌体衣壳蛋白基因融合,以融合蛋白的形式呈现在噬菌体的表面。这个技术最大优点是直接将表达出来的抗体与其基因型联系在一起,再利用抗原-抗体的特异性结合,将感兴趣的抗体挑选出来。通过噬菌体技术,可高效的获得scFv人源化片段,提高CAR-T的安全性和有效性。
噬菌体展示技术
资料来源:《浅谈抗体领域的研究成果》
scFv序列是CAR-T研发中的核心技术,从华创证券的调研信息来看,筛选一个合适的scFv序列时间成本和费用成本都不低,鼠源性的成本在几十万元,人源化的则需要上百万元。目前很多科研机构使用的序列是从文献上获取的,原则上只能用于科研。所以如果是要做创新型CAR-T,进行商业化,则需要科研机构或企业自主研发筛选。
三CAR-T的转染载体与制备工艺
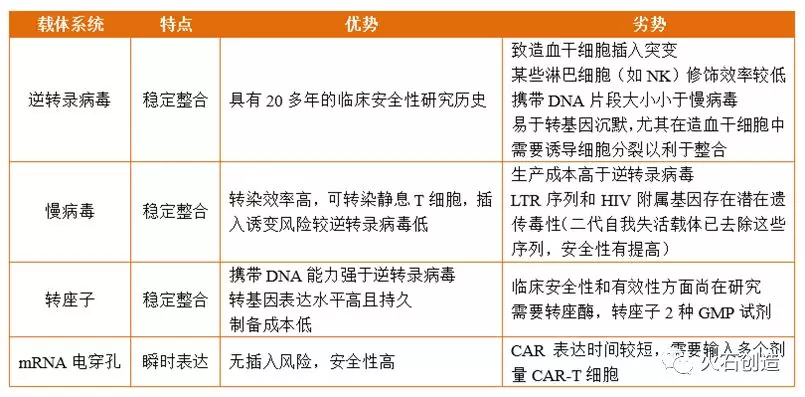
为实现CAR在T细胞上的表达,需要通过载体将CAR基因导入T细胞。理想的载体应该具有较高的基因转染效率,稳定性好,不引起机体免疫反应等特点。目前有多种载体用于CAR-T细胞产品制备,包括病毒载体转导(如γ-逆转录病毒载体或慢病毒载体)及非病毒载体转染(如转座子转染、mRNA电穿孔转染等)等,虽然已开展的临床试验中以病毒载体转导的方式为主,但以非病毒载体转染的方式也在不断得到青睐。
逆转录病毒是一种RNA病毒,只能转染分裂期细胞,目的基因可以长期表达,技术上较为容易,已具有20多年的临床安全性研究历史。慢病毒是以HIV病毒为基础发展起来的载体,对分裂细胞和非分裂细胞均具有感染能力,转染效率高,插入诱变可能性小,是目前应用最多的载体系统。病毒基因转移载体的主要优点是制造、生产相对容易以及能够将遗传物质稳定整合到宿主基因组中。然而,病毒载体的致病性和潜在的插入诱变可能性在人类临床试验中存在显着的监管障碍,非病毒载体的开发显得十分重要。转座子和mRNA电穿孔技术是目前研究比较多的两类非病毒载体系统。
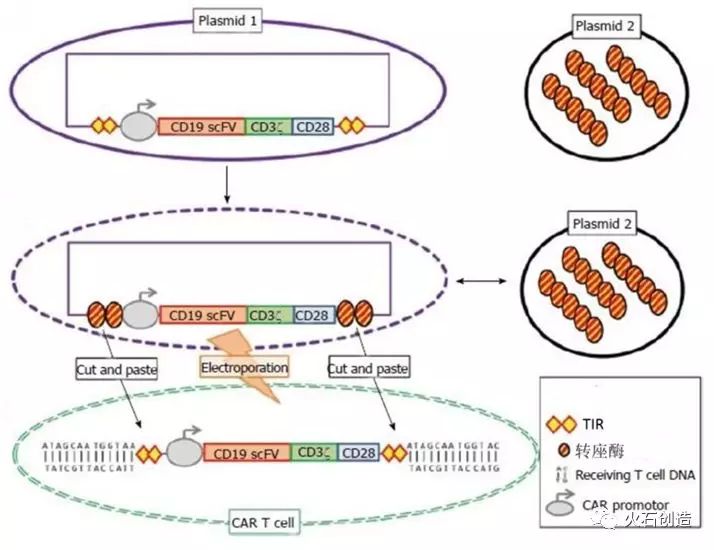
相较于病毒载体,转座子能呈递更大的负荷,成本效益高,免疫原性低。基于转座子的载体系统主要有两种类型:睡美人(Sleeping Beauty,SB)系统和PiggyBac系统。转座子最终可能发展成多功能T细胞基因转移系统,但目前的DNA电穿孔方法通常产生较差的细胞活力,临床应用中需要扩大T细胞培养以产生大量 T 细胞。
利用转座子构建CAR-T细胞的原理
资料来源:World J Stem Cells-< New insights in chimeric antigen receptors>
目前,mRNA电穿孔被认为是最安全的T细胞基因转导方法,其可转导静止或增殖缓慢的T细胞,转导效率多在90%以上,且设计相对容易,性价比高。临床上已经使用利用瞬时mRNA转染产生的CAR-T细胞,然而,这种方法需要几轮CAR-T细胞输注。在临床前模型中,mRNA电穿孔转导的靶向间皮素的CAR-T能引起播散性间皮瘤异种移植物的消退,然而,在灌输49天后一名患者出现了过敏性反应。
不同载体系统的比较
资料来源:华创证券
CAR-T细胞的制备需要一些小心操作的步骤,而且整个过程中都需进行质量监控测试。CAR-T的GMP制备工艺主要包括如下过程:T细胞收集和分离,T细胞激活和修饰,T细胞扩增,T细胞收获与回输。生产过程通常需要5-10天,从收集到回输需要2-4周(根据病人的临床状态和化疗预处理方案确定)。
四展望
CAR-T细胞制造是一个非常复杂的过程,制造难、成本高已经成为了行业发展的瓶颈问题。目前,吉利德和诺华公司均采用的是集中生产模式,首先在医院中提取患者的T细胞,然后将这些细胞运送至制造中心,在制造中心对T细胞进行基因工程设计,最后将设计后的T细胞运回医院回输至患者体内。然而,无论使用何种制造模式,成功的CAR-T细胞制造都依赖于端到端流程的优化能力,包括工作流程的简化、产能规划以及生产的可扩展性等等。传统的制造工艺以及传统设备已经不能满足行业发展需求,自动化、全封闭的新一代制造工艺是未来趋势。随着CAR-T制造工业的发展,目前市场上已经有一些解决方案供CAR-T开发商选择,例如博雅控股集团旗下的CAR-TXpress?、美天旎的CliniMACS Prodigy?以及GE公司的FlexFactory?等,这些平台受到了整个行业的关注,业内人士也对它们充满了期待。
自动化、全封闭的CAR-T制造工艺是规模化生产以及降低制造成本的有效途径。随着CAR-T疗法获批上市,市场对新一代制造工艺的需求日益剧增。目前,CAR-T制造创新专利陆续问世,CAR-T细胞合同定制开发与生产制造(CDMO)的服务模式也开始进入国内外市场,CAR-T疗法迎来了全新发展阶段,有望造福更多患者。
来源:火石创造
作者:木子鹏