“癌症转移”这四个字让肿瘤患者听到后毛骨悚然,因为癌症转移就意味着患者的生命进入倒计时,短短的一生即将结束。据再生医学网了解,肝脏是癌症转移的最佳器官,因为它具有丰富的血供,目前治疗癌症转移的最佳手段就是手术切除肿瘤,但仅仅适合于单一转移病灶的患者,而且无法保证预后的生存周期。那么有没有更好的治疗策略来抑制肿瘤的转移呢?下面
再生医学网就为您推送一条最新研究进展。
近年来,纳米靶向药物为转移癌的治疗带来了曙光,但癌转移过程中肿瘤细胞标志物丢失或者结构突变等问题,限制了纳米靶向药物的实际应用效果。
针对这一问题,南京大学现代工程于应用科学学院胡勇课题组与南京大学化学化工学院蒋锡群课题组,加州大学洛杉矶分校顾臻课题组展开国际合作,提出了一种不依赖标志物的肝转移癌治疗手段,有效清除癌细胞的同时最大限度保全肝细胞功能。
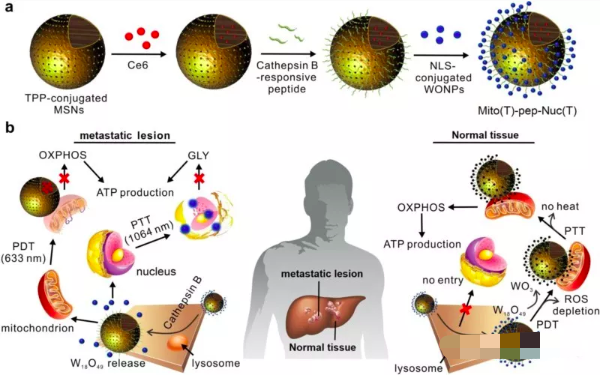
研究人员选取了多孔硅作为光动力药物的载体(A unit),通过Cathepsin B酶响应性氨基酸链段将非化学计量比氧化钨纳米球(B unit)偶联至硅球表面,形成一种行星-卫星结构。其工作原理如图一所示,肿瘤细胞内高酶切活性导致了A,B units的分离,并促成二者最终分别富集于线粒体和细胞核内。通过次序给予激光照射,经由线粒体和细胞核调控的氧化磷酸化和无氧糖酵解均被抑制,切断了癌细胞的能量来源—ATP的产生。正常的肝细胞及库普弗细胞(Kupffer cells)缺乏足够的酶切活性,纳米载体的结构得以维持,这导致第一步激光照射产生的活性氧被卫星状分布的非化学计量比氧化钨所吸收。在第二轮激光照射中,作为光热发生介质的B unit由于在第一轮与活性氧作用下,作为活性中心的W(IV)被氧化,而丧失了光-热转化能力,最终保护正常组织免受热损伤。
研究示图(图片来源于《自然·通讯》)
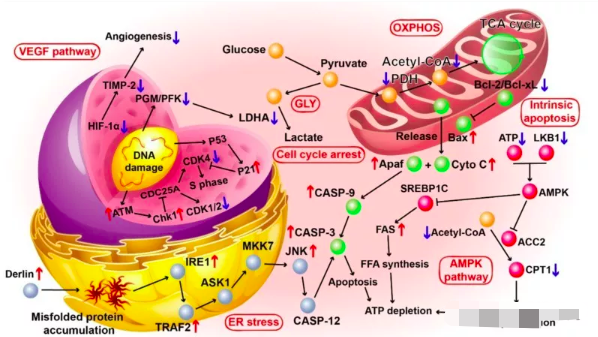
课题组进一步探究了上述“自淬灭”机制的实际应用效果和相关的分子生物学机制。Seahorse XF线粒体功能分析结果表明其所设计的材料可以迅速耗竭癌细胞内的ATP贮存,并藉此诱导细胞程序性死亡。基于对于基因组学和蛋白质组学数据的生信挖掘,研究人员证实联合治疗骗过了癌细胞内的能量感受器,同时通过诱导内质网应急和DNA损伤修复等方式进一步加速了细胞的ATP耗竭 (图二)。以一线晚期肝癌靶向药物索拉菲尼为对照,研究人员证实该课题中所设计的“自淬灭”治疗显著破坏肝转移灶的同时保全了肝功能,最终获得了两倍于化疗的生存收益。基于其所设计治疗方案不依赖于细胞标志物起效的特点,研究者相信该体系未来也有望在肝脏以外的器官癌转移治疗中发挥关键作用。
研究示图(图片来源于《自然·通讯》)
该成果近日以《Eradication of unresectable liver metastasis through induction of tumour specific energy depletion》为题发表在《自然·通讯》(Nature Communications)杂志上。南京大学现代工程与应用科学学院为本文第一通讯单位。现代工程与科学学院15届博士生霍达为本文第一作者,胡勇教授,蒋锡群教授和顾臻教授为本文共同通讯作者,该工作的顺利开展得到了胡勇教授课题组博士生朱剑峰,张超,蒋炜,罗星谕以及加州大学洛杉矶分校顾臻教授课题组陈国军博士和苏州大学陈倩教授的大力支持。
该项研究得到国家重点研发计划,国家自然科学基金,及南京大学优秀项目探索计划基金的支持。
再生医学网认为,这项新研究将为日后研发出靶向治疗策略提供助力,希望能够早日应用到临床上,为那些罹患癌症的患者带去福音,。