肝癌一般被发现时都是晚期,所谓“胃是喇叭,肝是哑巴”,意思是说,胃有病时会以不适或疼痛来提醒你,但肝有病时却没有什么征兆,一旦被发现,基本就是晚期。为了更好地研究肝癌的预防和治疗,有效地提高患者的生存率,近日我国科学家就人造肝脏研究有了最新研究进展,下面
再生医学网就为您推送这条资讯。
图片来源于网络
2019年7月22日,中国科学院上海生化细胞所惠利健等人在Nature Cell Biology 在线发表题为“Modelling liver cancer initiation with organoids derived from directly reprogrammed human hepatocytes”的研究论文,该研究使用直接重编程的人肝细胞(hiHeps)和p53和RB的失活,建立了具有肝脏结构和功能的
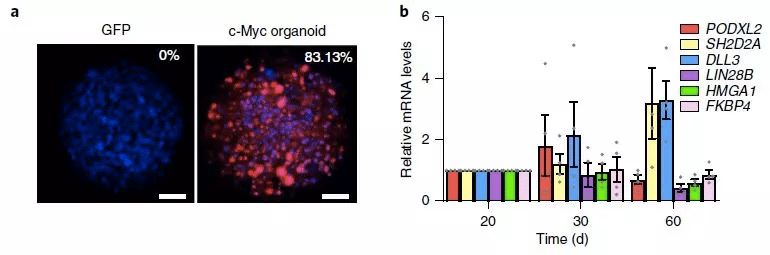
类器官。对HiHep类器官进行基因工程改造,以模拟人类肝癌的最初改变。由c-Myc诱导的过度线粒体 - 内质网偶联促进了肝细胞癌的发生,并且似乎是预防性治疗的目标。此外,通过对人肝内胆管癌富集突变的分析,证明了通过Notch和JAK-STAT的联合抑制可以预防RAS诱导的从肝细胞到肝内胆管癌细胞的谱系转化。总之,hiHep类器官代表了一种系统,可以通过遗传操作来模拟癌症的发生,并确定潜在的预防疗法。
2019年7月3日,中国科学院生物化学与细胞生物学研究所惠利健,李虹及中国科学院上海营养与健康研究所李亦学共同通讯在Cell Stem Cell 在线发表题为“A Homeostatic Arid1a-Dependent Permissive Chromatin State Licenses Hepatocyte Responsiveness to Liver-Injury-Associated YAP Signaling”的研究论文,该研究发现Arid1a控制肝脏再生和与损伤诱导肝脏祖细胞样细胞(LPLCs)的出现相关的基因表达。肝细胞特异性Arid1a缺失减少了几种周围型肝损伤模型中的LPLC基因表达,并损害肝脏再生,导致器官功能障碍。Arid1a在体内平衡期间在富含LPLC的基因上建立了一种允许的染色质状态,这表明它赋予肝细胞对损伤诱导信号的反应能力。一致地,Arid1a促进YAP(一种关键的再生信号传导途径)与富含LPLC的基因的结合,并且Arid1a缺失阻止其在损伤后的YAP相关诱导。总之,这些发现为研究损伤诱导的LPLC对门静脉周围肝再生的贡献提供了框架(点击阅读);
2018年11月8日,中科院生化细胞所惠利健等人在Cell stem Cell 杂志在线发表题为“In Vitro Expansion of Primary Human Hepatocytes with Efficient Liver Repopulation Capacity”的文章。该文章发现了:人肝细胞可以连续传代并扩增10000倍、ProliHHs在体外分化或移植后可以成熟等现象(点击阅读);
2018年6月21日,第二军医大学谢渭芬与中科院生化细胞所惠利健共同通讯在Cell Stem Cell在线发表题为“Chronic Liver Injury Induces Conversion of Biliary Epithelial Cells into Hepatocytes”的研究论文,该论文模拟人类慢性肝脏损伤,其中这种反应被钝化,没有基因操作,并评估了非实质细胞(NPC)对肝细胞再生的潜在贡献。显示NPC衍生的肝细胞补充长期硫代乙酰胺(TAA)或3,5-二乙氧基羰基-1,4-二氢可代骨素(DDC)处理引起的严重损伤后的大部分肝实质。通过对胆管上皮细胞(BECs)进行谱系追踪,显示BECs是新肝细胞的来源并且在门静脉周围区域和纤维化间隔中获得Hnf4α+ CK19 +双表型状态。双表型细胞也在肝硬化人肝脏中检测到。总之,这些数据进一步支持BECs肝细胞再生,无需遗传干预,并在严重肝损伤期间显示其细胞可塑性。
肝癌,以肝细胞癌(HCC)和肝内胆管癌(ICCs)为主要类型,是全球第六大常见癌症和第四大致死性恶性肿瘤。肝癌预后不良主要归因于疾病的晚期诊断,只有不到30%的肝癌患者在早期被诊断出来。了解肝癌发生的分子和细胞机制将有助于制定早期诊断策略和预防性治疗。全基因组测序已经确定了许多基因突变,并大大加强了我们对HCC和ICCs发展的理解。然而,大多数这些突变尚未被描述为它们是否能够驱动人类肝癌的起始,即使对于经典的癌基因如c-Myc也是如此。另一个重要的挑战是人类肝癌的细胞起源,分化的肝细胞和胆管细胞分别被认为是HCC和ICC的起始细胞。有趣的是,肝细胞可以在小鼠模型中转化为HCC和ICC 。然而,很难证明人类患者的起始细胞。鉴定肝癌中的起源细胞将允许系统分析与癌症起始和发展有关的遗传病变。
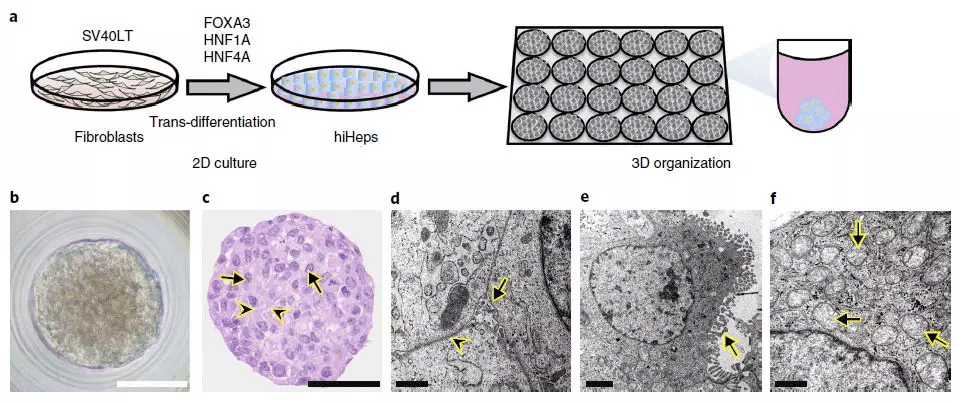
产生具有改善的肝结构的hiHep类器官(图片来源于《NATURE》)
开发模拟人类肝癌发生早期阶段的实验系统以分析HCC和ICC起始至关重要。基因工程小鼠模型是强大的工具;然而,小鼠和人肝细胞在许多特征上是不同的,包括代谢能力和转录因子网络。源自原发性人类癌症的癌细胞系和类器官概括了完整肝癌的突变和表达谱,但未能模拟癌症的发生。在癌基因表达后使用原代人类细胞的类器官提供了一种用于研究起始的稳健系统,如胰腺癌和结肠直肠癌所示。该方法有助于癌症突变的分析,并提供监测癌症发生的组织学变化的机会。
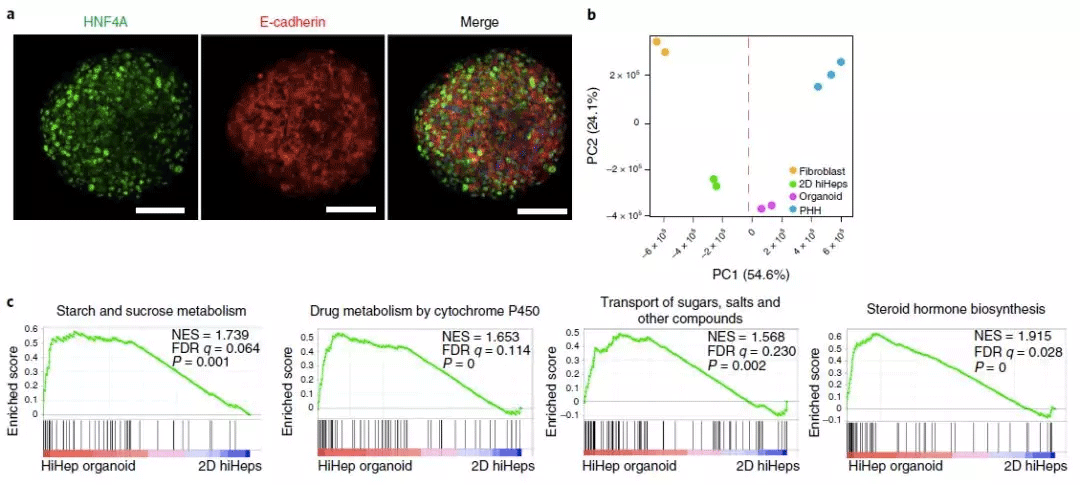
HiHep类器官具有改善的肝功能(图片来源于《NATURE》)
为了开发这种肝癌模型,需要一种用于原代人肝细胞(PHH)的培养和遗传操作的技术。在最近关于PHHs培养和扩展的出版物之前,这在技术上是困难的。然而,这些培养的PHH显示肝脏祖细胞或胎肝细胞的特征,使其适合于干细胞相关肝癌的研究。由于它们与PHH的功能相似性及其遗传操作的可行性,通过直接重编程产生的功能性肝细胞提供了PHH的替代物。
在原位移植c-Myc类器官后真正形成HCC(图片来源于《NATURE》)
在先前,研究人员使用FOXA3,HNF1A和HNF4A从成纤维细胞产生人诱导的肝细胞(hiHeps),并通过SV40大T抗原(SV40LT)扩增它们。HiHep细胞显示出显著的肝功能和重新填充的Fah缺陷型肝脏。
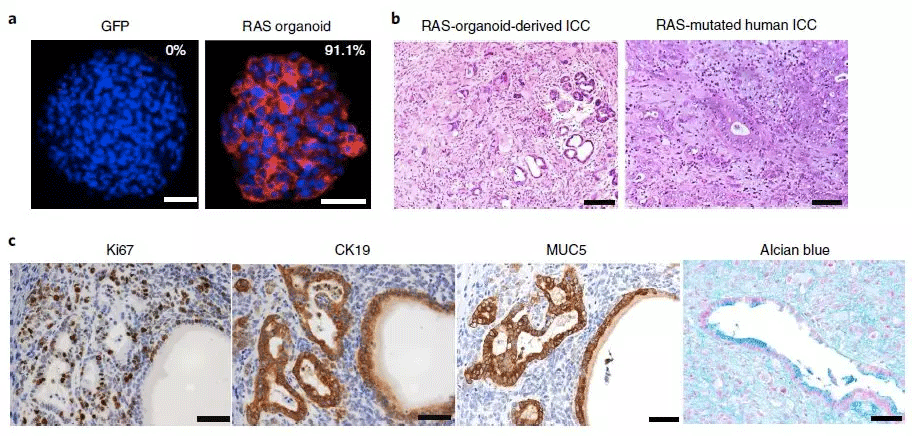
RAS在体内和体外均诱导ICC特征(图片来源于《NATURE》)
在这里,研究人员使用hiHeps建立一个显示肝功能和结构改善的类器官系统。使用hiHep类器官,研究人员发现c-Myc诱导的人类HCC起始与线粒体相关的内质网(ER)膜(MAM)的改变有关。此外,通过分析人ICC富集的突变,显示激活的RAS诱导肝细胞的ICC,谱系转换而不经过祖细胞阶段。该研究共同建立了一个模拟人类肝癌发生的模型,该模型可用于表征分子和细胞的变化以及制定预防策略。
再生医学网认为,一旦人
造肝脏制造出来,将为科学家更加深入的研究肝脏及肝脏疾病提供了供体,为早日开发出相关预防药物和靶向治疗药物提供了契机。