再生医学网近期获悉,伊利诺斯芝加哥大学的研究人员在《自然免疫学》杂志上发表了一项新研究,题为“The angiocrine Rspondin3 instructs interstitial macrophage transition via metabolic-epigenetic reprogramming and resolves inflammatory injury”。
这项研究特别关注了肺损伤动物模型中的巨噬细胞编程。研究人员表示,“我们发现巨噬细胞的编程不仅仅是由免疫系统驱动的,它还受到巨噬细胞所居住的环境的驱动,我们的研究证明了肺内皮细胞,也称血管中的细胞,在具有强大组织修复和抗炎功能的巨噬细胞编程中是必不可少的。”
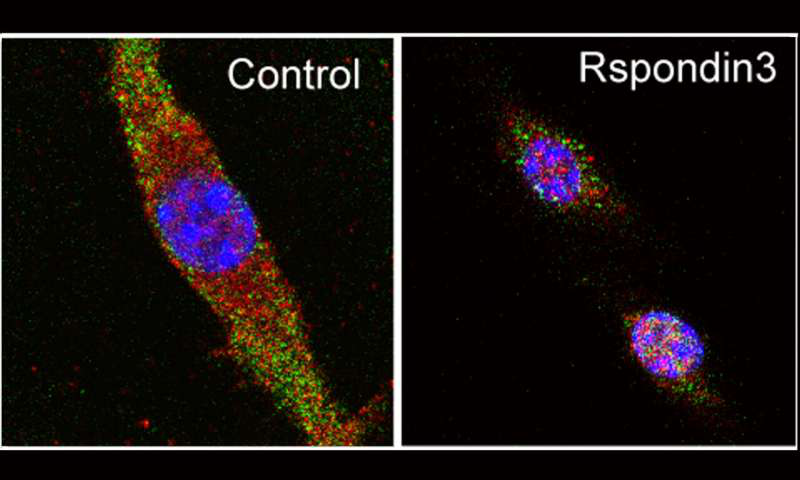
巨噬细胞的荧光图像显示细胞核(蓝色)和分子级联蛋白(绿色)和TET2(红色),这使巨噬细胞编程成为可能。
UIC医学、药理学和再生医学教授、该论文的第一作者之一Jalees Rehman博士说:“我们证明,肺内皮细胞(血管中的细胞)在具有强大组织修复和抗炎功能的巨噬细胞编程中是必不可少的。”
研究小组首先分析了由血管细胞释放的作为化学信号的蛋白质,然后进行了实验,检查这些信号是否会影响巨噬细胞的功能,结果发现,一种名为Rspondin3的蛋白质在炎症损伤期间会大量释放,并在巨噬细胞编程中发挥关键作用。
ECs通过血管分泌因子Rspondin3指导巨噬细胞表型转变。
该研究的第一作者、UIC的药理学和再生医学研究助理教授周毕生(Bisheng Zhou)表示,“当我们从血管内皮细胞中移除负责Rspondin3的基因时,我们观察到巨噬细胞并不能减缓炎症。相反,肺部会受到更严重的损伤。我们在炎症性肺损伤的多种模型中进行了尝试,发现了一致的结果,提示血管在指导巨噬细胞的编程中发挥了重要的指导作用。”
Rspondin3介导肺IM表型转变,预防炎症性肺损伤。
Rehman说:“大多数人肺部感染后会康复,但不幸的是,一小部分患者会出现严重的肺损伤,表现为ARDS,这就是我们在最近COVID-19大流行中看到的情况。可能是这些病人有潜在的、可能未被诊断的血管健康状况不佳,因此,血管未能向巨噬细胞发送适当的信号,并阻止炎症。一旦细菌或病毒被消灭,就缺乏足够的自动制动系统来减缓炎症,这将导致我们身体不受控制的免疫系统对脆弱的组织和器官(如肺)造成更大的损害。”
Rehman说,尽管这项研究的重点是肺部,但它的发现也可能与心脏、肠道、大脑和肝脏等其他器官的疾病有关,如果促炎细胞和抗炎细胞之间的必要平衡被破坏,这些器官的免疫细胞可能会造成损害。
(备注:图片源自网络。)




