再生医学网认为,肝脏是人类腹腔中最大的器官,成人的肝脏一般重1500g左右,1分钟流经肝脏的血液量亦高达1000ml以上。然而,肝脏确具有极强的再生和恢复的能力。若将肝脏切掉一半,或者当受到严重的创伤,残留的正常肝细胞仍然能够从事正常的工作。肝脏再生包括肝实质细胞再生和肝组织结构的重建,肝细胞在再生中起重要作用。
肝再生(ALR)蛋白(由生长因子ERV1同源基因编码)的增强剂在肝脏中高表达,主要在肝细胞中,并在细胞质,细胞核和线粒体中发现。肝细胞分泌ALR,并且是血清中的主要来源。ALR的线粒体功能至关重要,因为它的耗竭会导致三磷酸腺苷(ATP)迅速丢失,从而导致细胞死亡。ALR在小鼠中的整体敲除具有胚胎致死性,表明其在胚胎发育中至关重要。肝细胞特异性敲除ALR的小鼠在出生时正常,但会出现过度的脂肪变性,线粒体功能障碍和变性,并迅速死亡。非酒精性脂肪肝疾病(NAFLD)的发病率增加是全球性的挑战。NAFLD中有44%的患者会发展为非酒精性脂肪性肝炎(NASH),而具有明显NASH的受试者会发展为肝硬化和肝细胞癌。本项研究假设ALR缺乏可能是NASH及其在基础疾病未被诊断的受试者中无声发展为纤维化/肝硬化的重要诱因。
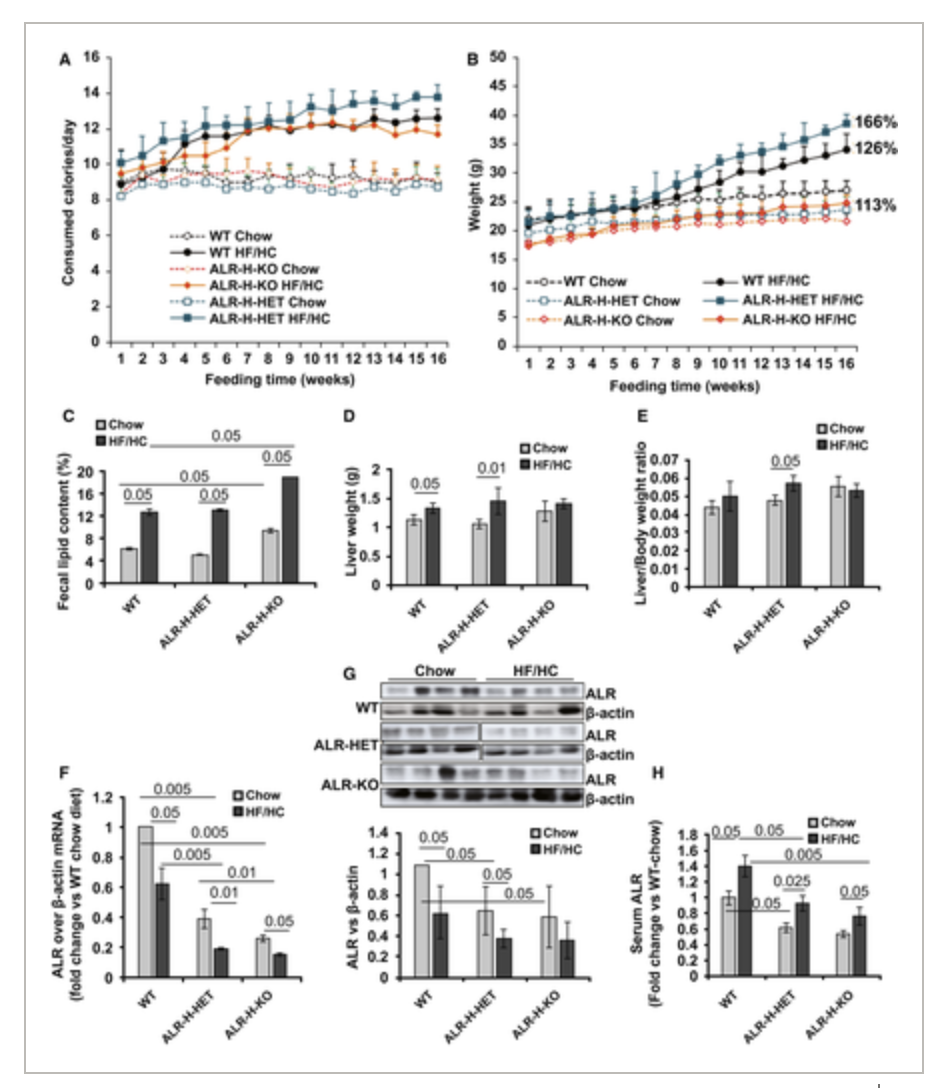
高脂/高碳水化合物(HF/HC)喂养降低了所有小鼠的ALR表达。当用HF/HC饮食进行代谢攻击时,ALR小鼠比WT小鼠体重增加更明显和脂肪变性也更严重。ALR敲除小鼠的体重最少,脂肪变性最少。这些发现与甘油三酯和胆固醇的相应增加以及肉碱棕榈酰转移酶1a,固醇调节元件结合蛋白,乙酰辅酶A羧化酶和脂肪酸合酶的表达改变相一致。所有用HF/HC喂养的小鼠均出现胰岛素抵抗,在ALR敲除小鼠中幅度较小。HF/HC喂养的ALR小鼠比WT或ALR敲除小鼠对葡萄糖攻击的抵抗力更高。产生肿瘤坏死因子的频率,产生白介素6(IL6)的频率,产生IL17的细胞在ALR敲除小鼠中比ALR鼠中更大,在WT小鼠中最低。HF/HC喂养在ALR敲除小鼠中并未增加其数量,除IL17细胞外,ALR小鼠体重的增加大于野生型小鼠。HF/HC喂养仅在野生型小鼠中降低调节性T细胞频率。HF/HC喂养的ALR小鼠但未出现肝脏纤维化。ALR敲除小鼠发展为肝硬化的可能性更高。HF/HC喂养的ALR缺乏小鼠的白色脂肪组织发生强烈的炎症反应,表明与肝脏出现了双向相互作用。NASH肝硬化患者的肝和血清ALR水平显着降低。NASH患者的血清ALR也显着降低。
由此,研究人员得出一个结论:肝ALR缺乏可能是侵袭性NAFLD进展的关键诱发因素。
(备注:图片源自网络。)




