众所周知,细胞是组成人体和形态的的基本单位。活体微环境中细胞会经受各种不同的物理力的作用,诸如延伸的拉力、静水的压力。然而细胞自身对于外界信号是有感知和响应能力的,这是细胞本身自带的特性即——自我调节以适应和应答外界环境外力。针对细胞的特异性功能,
再生医学网最近获悉,北京航空航天大学研究团队在期刊发表的研究论文声称,正着力于研发的高通量、单细胞精度的活细胞力学检测生物芯片。
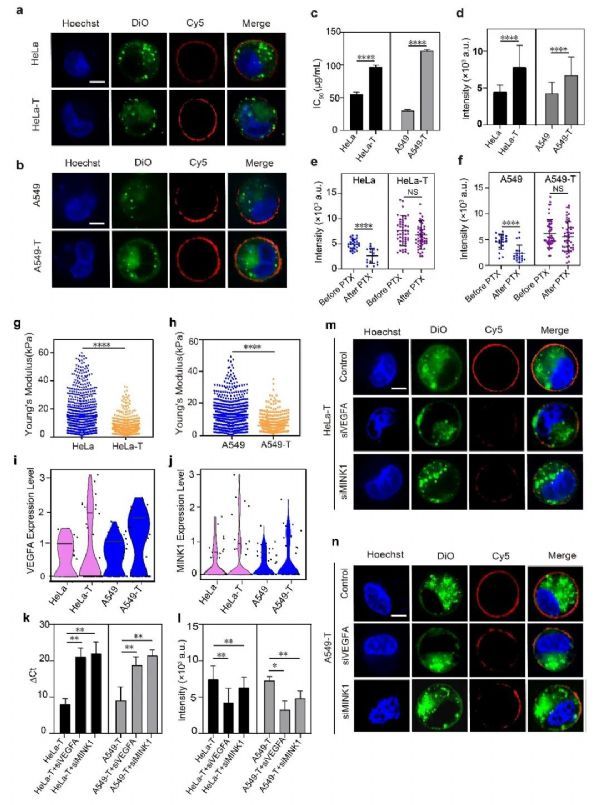
该项研究通过精确设计阵列化、图形化的单细胞微孔阵列芯片,保证高通量细胞定向操纵(单次可达10E6个细胞/芯片),从细胞数量上达到群体细胞行为研究的要求。
同时微孔底部修饰了一种用于荧光成像的DNA张力传感器,用于细胞机械力的高分辨成像。该DNA张力传感器可以通过修饰的胆固醇自发地嵌入细胞膜,在外界环境的刺激下,细胞机械特性的变化通过DNA张力传感器诱导发夹结构的变化,导致荧光基团和淬灭基团的分离,从而产生荧光信号。该DNA张力传感器可以通过调节发夹结构的长度与序列对所测的阀值进行调控,其测量精度可达到pN级。
研究结果证明了耐药性肿瘤细胞与非耐药性肿瘤细胞之间存在明显的机械异质性。相比非耐药性肿瘤细胞,对于化疗药物紫杉醇具有一定抗性的耐药性肿瘤细胞的硬度降低,细胞机械力引起的荧光信号升高。
为了进一步分析导致单细胞机械异质性的原因,研究团队通过单细胞RNA测序技术证实了两个细胞群之间潜在的遗传异质性,结果显示耐药性细胞中与细胞骨架重塑有关的两种基因VEGFA和MINK1的表达量普遍增加。
最后研究团队再通过将siVEGFA和siMINK1转染到耐药性肿瘤细胞中,下调了这两个基因的表达水平。得出的数据结果表明,伴随着相关基因表达量的下调,耐药性肿瘤细胞的荧光信号明显下降,证实了VEGFA和MINK1与耐药性细胞机械力增加的机制呈正相关,提示VEGFA和MINK1可能参与了肿瘤细胞形成耐药性过程中的机械调控。
再生医学网对此表示,细胞作为构成生命集体的基本单位,这一项研究成果的突破,使人类对细胞有了深入层次的了解,期待不久的将来,人类会克服种种难关,定能展望未来。