癌症每年会夺走很多人的生命,全球每年的癌症患者也在不断攀升。在众多癌症中,结肠癌变在全球癌症死亡率中排名第二,50%的CRC死亡是由肝转移引起的。
再生医学网近日获悉,复旦大学上海癌症中心的科研人员发现富含miRNA的细胞外囊泡可重塑肿瘤微环境,相关内容再生医学网为大家推送。
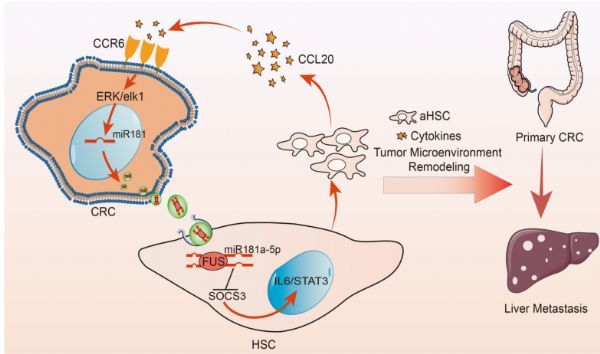
研究人员声称该发现,高转移的大肠癌细胞释放富含miR-181a-5p的EV,通过调节CRC细胞和HSCs之间的相互作用,以及TME的重塑,促进肝转移。这些发现确定了CRLM的一种新的特异性生物标志物,以及一种预测由结直肠癌引起的继发性肝癌风险的新策略。
科研团队检测了CRC细胞是否可以通过EVS激活HSCs,然后选取两株转移潜能较弱的大肠癌细胞株和两株高转移细胞株,从条件培养基(CM)中分离纯化EV。研究人员还发现高转移的CRC细胞可以向HSCs输送更多的EVS,这表明高转移的CRC来源的EVS可能在HSCs和CRC细胞之间的相互作用中发挥关键作用。
此外,研究人员也亲自验证了miR-181a-5p包装到CRC EVS中,进而通过靶向SOCS3和激活IL6/STAT3信号通路而持续激活肝星状细胞。研究团队证明高转移的CRC来源的EV miR-181a-5p通过调节IL6/STAT3信号激活了HSCs。这促进了α-HSCs分泌CCL20,并通过CCR6进一步激活ERK1/2/ELK-1通路,上调了大肠癌细胞的表达,最终导致TME的重新编程以及肝CRLM中转移前生态位的形成。
再生医学网对此表明,此次重大发现,加深了我们对肿瘤细胞与TME相互作用机制的理解,也象征着人类在生物技术的发展上提升了新的水平。