据
再生医学网了解,在美国,截至2015年约有4.8%人群患有不同程度的慢性肾脏疾病,而其中有70324万人次已经属于终末期肾病。对于这一部分病人,虽然透析能暂时维持其生存,但肾脏移植仍是最根本的治疗方法。
肾移植术后长期存活和生活质量的提高是每个肾移植受者和移植医护人员的共同目标。一个成功的肾移植,不仅需要有良好的配型、娴熟的外科技术和巧妙地应用免疫抑制药物,更重要的是对并发症的及时诊断与恰当的治疗,才能获得预期效果,达到及时挽救移植肾,保全肾移植受者生命的目的。
事实上,在全美每年约有十万肾衰竭病人等待肾脏移植,但是每年有近九千病人由于没有合适肾源,病情恶化而死亡。因此,肾源短缺仍是最严峻问题。
随着组织工程的发展,3D结构仿生肾脏已经能逐步代替肾脏的部分或全部功能。
一般来讲,构建仿生肾脏遵循如下步骤:①分离并培养肾脏细胞或者干细胞;②将细胞移至3D结构肾脏支架,继续培养;③将3D结构仿生肾脏置于生物反应器中预处理,培养至成熟;④将成熟的3D结构仿生肾脏支架移植入体内,实现器官再造。
虽然目前
3D生物打印技术能模拟器官组织的几何学结构,但是如何使组织工程仿生器官血管化,促进其功能发挥是当下亟需解决的关键问题。
近期,美国维克森林医学院再生医学研究所詹姆斯教授团队通过血管铸型技术构建血管化3D结构肾脏仿生支架,并实现生物支架的体内功能化。
首先研究者将PCL融于丙酮中,通过肾动脉注入大鼠一侧肾脏,随后丙酮在室温条件下挥发,而肾脏组织用NaOH溶解,留下PCL为材料的血管铸造模型。随后以鼠尾胶原孵育PCL血管支架,然后用丙酮溶解PCL,形成中空的胶原管状结构。研究者将MS1内皮细胞种植于仿生血管支架上,继续与肾脏细胞共培养。经过一段时间培养后,肾脏细胞能自发的形成管型结构。
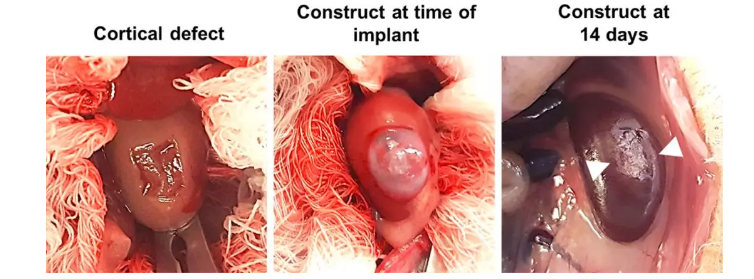
研究者建立了肾皮质缺损模型,并将仿生生物支架植入缺损区域,用纤维蛋白胶粘住,14天后肉眼观察仿生生物支架仍在原位置。
研究者对构建的3D仿生肾脏结构进行组织切片,通过H&E染色能清晰看出内皮细胞围绕仿生血管形成完整的层状结构。免疫荧光也证实仿生血管周围覆盖完整的MS1内皮细胞。此外,HLA是肾细胞特异性标记物,Na+/K+ATP酶是肾近端小管的特异性标记物,通过免疫荧光染色发现二者存在共定位,这提示肾细胞可形成类似肾小管的管型结构。
移植两周后,研究者再次通过H&E染色比较不同组别组织结构特点,其中CH代表只有胶原水凝胶,VS代表只有仿生血管支架而无细胞,MVS代表只有仅有MS1内皮细胞培养的仿生血管支架,MVSR代表同时有MS1及肾细胞共培养的仿生血管支架。结果发现在有MS1内皮细胞共培养的仿生血管支架内有红细胞存在,并且与是否有肾细胞共培养无关。
研究者进一步通过免疫荧光分析上述不同组别组织结构特点。Fig. 5A是正常的肾组织,Fig. 5B是用移植胶原水凝胶的组织,Fig. 5C是移植仿生血管支架的组织,Fig. 5D是移植有MS1共培养的仿生血管支架,Fig. 5E是移植有MS1及肾细胞的仿生血管支架。通过比较发现,培养MS1内皮细胞能促进支架的血管化,而当加入肾细胞共培养后更能促进支架血管化发生。并且通过免疫荧光共标发现MS1内皮细胞与本体组织内皮细胞存在共标,提示有二者共同组成混合血管结构,并且当加入肾细胞共培养后能促进混合血管形成。
仿生支架的血管化能促进本体组织肾细胞迁移入支架中并保持活性。其中Na+/K+ATP酶用来标记极化的近端肾细胞。免疫荧光发现单纯的胶原或者单纯的仿生支架结构中仅有极其少量的Na+/K+ATP阳性极化的近端肾细胞。当有MS1共培养时,仿生支架内迁移入的本体肾细胞增加,当共培养肾细胞时更能促进本体肾细胞迁移,并能形成一些管状结构。
综上所述,本研究的
仿生血管支架有助于本体组织细胞迁移入支架中,而仿生血管支架与内皮细胞共培养后,可促进仿生血管与本体血管融合。肾细胞与仿生支架共培养则可形成类似于肾小管的管型结构。该研究由美国维克森林医学院再生医学研究所詹姆斯教授团队完成,于2019年4月3日在线发表于Acta Biomaterialia。
我们也越来越坚信,随着各国科学家们的不懈努力,能够为越来越高发的肾脏疾病提供新的治疗方向,肾脏再生终有一天也不再是梦想!
再生医学网将持续关注。