再生医学网了解到,近日国际顶尖期刊《Nature Immunology》上发表了一项新研究,研究内容是一种新型的
癌症免疫疗法。这种疗法主要面向的癌症有三阴性乳腺癌、黑色素瘤和胰腺癌等难治性癌症,研究结果显示,这种新型疗法对患有以上三种癌症的小鼠模型中取得了良好的抑制效果。一旦这项研究在人体实验中得到证实,那就大大提高难治性癌症患者的生存周期及治愈几率。
相关研究已经发表在《Nature Immunology》
目前主要的癌症免疫疗法包括免疫检查点抑制剂疗法,过继性细胞疗法,重组细胞因子,以及癌症疫苗等,其基本原理是提高免疫系统对癌细胞的识别和杀伤能力,因而免疫系统对肿瘤相关抗原(tumor-associated antigens,TAAs)的特异性识别和杀伤能力是决定该类疗法成败的关键。然而TAAs可能存在先天自发性的表达不足和对其识别的不足,也有可能出现后天习得的抗原表达下调,甚至完全沉默某些抗原的表达和呈递。这些现象加上肿瘤免疫微环境的进一步抑制,很容易导致免疫逃逸的发生。尽管癌症免疫疗法在临床癌症治疗中取得了巨大的成功,但仅有一部分患者能从中获益。我们无疑需要新的思路和方法去提高肿瘤细胞表面特异性抗原的表达和呈递。
本研究的通讯作者陈斯迪教授
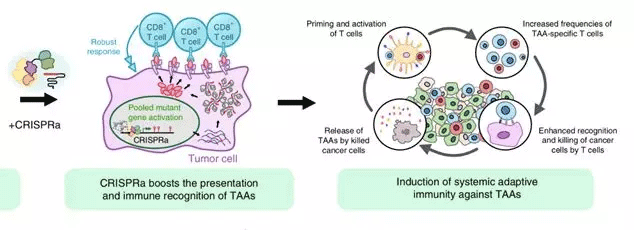
研究人员们在今日的论文中提出了一种名为“
集成内源基因激活免疫疗法”(Multiplex Activation of Endogenous Genes as Immunotherapy)的新型癌症免疫疗法,缩写为MAEGI。MAEGI利用“CRISPR激活”(CRISPRa)技术,将不具有核酸酶活性的Cas9蛋白与转录激活因子融合,再由sgRNA引导到靶基因的位置,来激活多个指定目标基因的表达,借此促进潜在内源性抗原的表达,进而达到提高免疫识别和免疫清除的目的。
研究者们证明了CRISPRa技术能在细胞水平上增强靶基因相关抗原的表达和呈递,进而诱导更强的效应T细胞反应。此外,其诱导的内源基因激活还能在小鼠模型中,让肿瘤细胞更容易被机体免疫系统清除。这为MAEGI的概念奠定了基础。
CRISPRa能提高TAAs表达和呈递,诱导更强的过继免疫反应
研究者使用了相对安全的腺相关病毒(AAV)作为基因载体,来解决MAEGI疗法的递送,鉴于单个肿瘤具有与正常组织区分开的独特的基因突变谱,为了实现精准治疗(p-MAEGI),研究人员通过全外显子测序,找出一个三阴性乳腺癌细胞系的所有突变基因,生成了仅靶向肿瘤组织,涵盖了1116个突变基因的3839个sgRNA文库,以及相应的AAV-p-MAEGI库,再通过瘤内注射方式来递送,并靶向激活所有可以产生肿瘤新抗原的突变基因。试验显示,44%的原位瘤产生完全/近完全缓解,67%的非直接注射的同体非原位瘤也产生了完全缓解。值得一提的是,p-MAEGI疗法治愈的小鼠三个月后仍然可以完全清除同种肿瘤的攻击,并保持了6个月以上的完全缓解,表明p-MAEGI产生免疫反应的全身性,长效性和持久性。
AAV-p-MAEGI疗法示意图
进一步的结果显示,AAV-p-MAEGI疗法改变了肿瘤的微环境,不仅提高了主要组织相融复合体 II(MHC-II)和抗原呈递细胞(APC)的比例,还提高了CD4阳性T细胞、CD8阳性T细胞对肿瘤的浸润,并改变了肿瘤浸润免疫细胞(TIIC)的成分,这些最终导致了肿瘤的消退。
因为MAEGI的全新作用机制,使得它能够独立于已有的癌症免疫疗法。MAEGI理论上能与标准疗法或者其他免疫疗法结合,有望带来全新的治疗方式,应用于多种癌症。
再生医学网认为,新型疗法具有安全性高、抑制力强等优点,或许能为治疗三阴性乳腺癌等难治性癌症带来新的希望,让我们共同期待它应用在临床的那一天。